ДЕРЖАВНИЙ ЕКСПЕРТНИЙ ЦЕНТР
МІНІСТЕРСТВА ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ДУ «ІНСТИТУТ ОТОЛАРИНГОЛОГІЇ ІМ. ПРОФ. О.С.КОЛОМІЙЧЕНКА»
НАМН УКРАЇНИ
УКРАЇНСЬКЕ НАУКОВОГО МЕДИЧНЕ ТОВАРИСТВО ЛІКАРІВ
ОТОРИНОЛАРИНГОЛОГІВ
АСОЦІАЦІЯ ДИТЯЧИХ ОТОРИНОЛАРИНГОЛОГІВ УКРАЇНИ
УКРАЇНСЬКА АСОЦІАЦІЯ СІМЕЙНОЇ МЕДИЦИНИ
АСОЦІАЦІЯ ПЕДІАТРІВ УКРАЇНИ
ГОСТРИЙ СЕРЕДНІЙ ОТИТ
КЛІНІЧНА НАСТАНОВА, ЗАСНОВАНА НА ДОКАЗАХ
2016
2
Склад
мультидисциплінарної робочої групи з опрацювання клінічної настанови
Заболотний
директор
Державної
установи
«Інститут
отоларингології
Дмитро Ілліч
ім. проф. О.С. Коломійченка» НАМН України, академік НАМН
України, д.мед.н., професор;
Ліщишина Олена
директор Департаменту стандартизації медичних послуг Державного
Михайлівна
підприємства «Державний експертний центр МОЗ України», к.мед.н.,
ст. н. с.;
Безшапочний
завідувач кафедри оториноларингології з офтальмологією Вищого
Сергій
державного навчального закладу України «Українська медична
Борисович
стоматологічна академія», д. мед. н., професор;
Березнюк
завідувач
кафедри
оториноларингології
Державного
Володимир
закладу »Дніпропетровська
медична
академія
МОЗ України»,
Васильович
д.мед.н., професор;
Василюк Наталія
доцент кафедри оториноларингології та офтальмології з курсом
Василівна
хірургії голови і шиї Державного вищого навчального закладу
«Івано-Франківський національний медичний університет», к.мед.н.,
доцент;
Гарюк Григорій
завідувач кафедри отоларингології та дитячої отоларингології Харківської
Іванович
медичної академії післядипломної освіти, д.мед.н., професор;
Заболотна Діана
старший науковий співробітник відділу запальних захворювань ЛОР-
Дмитрівна
органів
Державної
установи
«Інститут
отоларингології
ім. проф. О. С. Коломійченка» НАМН України, д.мед.н.;
Зарицька
провідний науковий співробітник відділу запальних захворювань
Ірина
ЛОР-органів Державної установи «Інститут отоларингології
Станіславівна
ім. проф. О.С. Коломійченка» НАМН України, к.мед.н.;
Кононов
асистент кафедри сімейної медицини та амбулаторно-поліклінічної
Олександр
допомоги Національної медичної академії післядипломної освіти
Євгенович
імені П. Л. Шупика, к.мед.н.;
Косаковський
завідувач кафедри дитячої оториноларингології, аудіології та
Анатолій
фоніатрії Національної медичної академії післядипломної освіти
Лук’янович
імені П. Л. Шупика, д. мед. н., професор, головний позаштатний
спеціаліст МОЗ України зі спеціальності «Дитяча отоларингологія»;
Лукач Еврін
завідувач ЛОР-онкологічним відділенням Державної установи
Венцлович
«Інститут отоларингології ім. проф. О.С.Коломійченка НАМН
України», д.мед.н., професор, головний позаштатний спеціаліст
МОЗ України зі спеціальності «Онкоотоларингологія»;
Матюха Лариса
завідувач кафедри сімейної медицини та амбулаторно-поліклінічної
Федорівна
допомоги Національної медичної академії післядипломної освіти
імені П.Л. Шупика, д.мед.н., професор, головний позаштатний
спеціаліст МОЗ України зі спеціальності «Загальна практика-сімейна
медицина»;
3
Писанко Віктор
головний науковий співробітник відділу ЛОР-патології дитячого віку
Миколайович
Державної
установи »Інститут
отоларингології
ім.
проф. О.
С. Коломійченка», д. мед. н., головний позаштатний спеціаліст МОЗ
України зі спеціальності «Сурдологія»;
Попович Василь
завідувач кафедри оториноларингології та офтальмології з курсом
Іванович
хірургії голови і шиї Державного вищого навчального закладу
«Івано-Франківський національний медичний університет», д.мед.н.,
професор, головний позаштатний спеціаліст МОЗ України зі
спеціальності «Отоларингологія»;
Пухлик Сергій
завідувач кафедри оториноларингології Одеського національного
Михайлович
медичного університету, д.мед.н., професор;
Шидловська
провідний науковий співробітник лабораторії професійних порушень
Тетяна
голосу і слуху Державної установи «Інститут отоларингології
Анатоліївна
ім. проф. О.С. Коломійченка НАМН України», д.мед.н., професор;
Шкоба Ярослав
завідувач відділення отоларингології Київської обласної клінічної
Васильович
лікарні, головний позаштатний спеціаліст Департаменту охорони
здоров’я Київської обласної державної адміністрації зі спеціальності
«Оториноларингологія»;
Шкорботун
завідувач кафедри оториноларингології Національної медичної
Володимир
академії післядипломної освіти ім. П.Л. Шупика, д.мед.н., професор;
Олексійович
Юрочко
Федір лікар відділення дитячої отоларингології Комунального закладу
Богданович
Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ», головний
позаштатний спеціаліст Департаменту охорони здоров’я Львівської
ОДА зі спеціальності «Дитяча отоларингологія»;
Ященко Юрій
завідувач наукового відділу організації медичної допомоги
Борисович
Державної
наукової
установи
«Науково-практичний
центр
профілактичної та клінічної медицини» Державного управління
справами, професор кафедри неонатології Національної медичної
академії післядипломної освіти ім. П.Л. Шупика, д.мед.н., професор.
Методичний супровід та інформаційне забезпечення
Горох Євгеній
начальник відділу якості медичної допомоги та інформаційних
Леонідович
технологій
Департаменту
стандартизації
медичних
послуг
Державного підприємства «Державний експертний центр МОЗ
України», к.т.н.;
Мельник Євгенія
начальник відділу доказової медицини Департаменту стандартизації
Олександрівна
медичних послуг Державного підприємства «Державний експертний
центр МОЗ України»;
Мігель Олександр завідувач сектору економічної оцінки медичних технологій
Володимирович
Департаменту
стандартизації
медичних
послуг
Державного
підприємства «Державний експертний центр МОЗ України»;
Шилкіна Олена
начальник відділу методичного забезпечення новітніх технологій у
Олександрівна
сфері охороні здоров’я Департаменту стандартизації медичних
послуг Державного підприємства «Державний експертний центр
МОЗ України».


4
Державний експертний центр МОЗ України є членом
Guidelines International Network
(Міжнародна мережа настанов)
ADAPTE (Франція)
(Міжнародний проект з адаптації клінічних
настанов)
Рецензенти
Бекетова Галина
завідувач кафедри дитячих і підліткових захворювань Національної
Володимирівна
медичної академії післядипломної освіти імені П. Л. Шупика,
д.мед.н., професор, головний позаштатний спеціаліст МОЗ України
зі спеціальності «Педіатрія»;
Дєєва Юлія
завідувач кафедри оториноларингології Національного медичного
Валеріївна
університету ім. О. О. Богомольця, д.мед.н., професор.
Перегляд адаптованої клінічної настанови заплановано на 2019 рік
link to page 6 link to page 7 link to page 8 link to page 10 link to page 11 link to page 11 link to page 15 link to page 67 link to page 72
5
ЗМІСТ
Список скорочень .............................................................................................................................. 6
Передмова робочої групи з адаптації клінічної настанови «Гострий СЕРЕДНІЙ ОТИТ» ........ 7
Резюме ................................................................................................................................................ 8
Вступ ................................................................................................................................................. 10
Словник термінів ......................................................................................................................... 11
Методи .............................................................................................................................................. 11
Ключові практичні висновки .......................................................................................................... 15
Впровадження настанови ................................................................................................................ 67
Література......................................................................................................................................... 72
6
СПИСОК СКОРОЧЕНЬ
AAFP
Американська академія сімейних лікарів
AAP
Американська академія педіатрії
AHRQ
Агентство з досліджень і якості медичного обслуговування
FDA
Управління з санітарного нагляду за якістю харчових продуктів та
медикаментів (США)
NNT
кількість хворих, яких необхідно пролікувати
PCV13
13-валентна пневмококова кон’югована вакцина
PCV17
Семивалентна пневмококова кон’югована вакцина
SNAP
Призначення антибіотика на 5 днів з моменту відвідування лікарні
WASP
Тактика очікування під час призначення препарату (варіант – тактика
уважного спостереження (ТУС)
БП
Барабанна перетинка
ГСО
Гострий середній отит
ДІ
Довірчий інтервал
ЖАІВПГ Жива атенуйована інтраназальна вакцина проти грипу
ЗОЗ
Заклад охорони здоров’я
КМП
Клінічний маршрут пацієнта
КТ
Комп’ютерна томографія
ЛПМД
Локальний протокол медичної допомоги
МІК
Мінімальна інгібіторна концентрація
МКХ
Міжнародна класифікація хвороб
МРТ
Магнітно-резонансна томографія
РКД
Рандомізоване контрольоване дослідження
РП
Різниця показників
РСО
Рецидивуючий середній отит
СО
Середній отит
ССВ
Секрет у середньому вусі
ССО
Секреторний середній отит
СШ
Співвідношення шансів
ТІВПГ
Тривалентна інактивована вакцина проти гриппу
УКПМД
Уніфікований клінічний протокол медичної допомоги
7
ПЕРЕДМОВА РОБОЧОЇ ГРУПИ З АДАПТАЦІЇ КЛІНІЧНОЇ
НАСТАНОВИ «ГОСТРИЙ СЕРЕДНІЙ ОТИТ»
Проблема гострих запальних захворювань верхніх дихальних шляхів, гострого середнього
отиту (ГСО) зокрема, є однією з найактуальніших у сучасній клінічній медицині. Останніми
роками спостерігається зростання частоти захворювань вуха, що проявляється
збільшенням як абсолютних (захворюваності та поширеності), так і відносних (частка в
структурі отоларингологічної патології) показників. ГСО є найчастішою бактеріальною
хворобою немовлячого і дитячого віку: майже всі діти мали принаймні 1 епізод або
приблизно третина переносять 3 або більше епізодів ГСО в перші 3 роки життя.
Європейські дані свідчать про 268 випадків ГСО на 1000 дітей за рік. Європейські дані
свідчать про 268 випадків ГСО на 1000 дітей за рік.
Хвороба має великий медичний, соціальний та економічний вплив. ГСО завжди потребує
істотних клінічних і фінансових затрат, які включають щонайменше один візит до лікаря,
виписування знеболювальних і переважно антибіотиків (більш як 80% в Італії і більш як 40%
у Німеччині). Мало того, ГСО може призвести до серйозних ускладнень, таких як
мастоїдит. Непряма вартість хвороби ще вища, тому що включає відсутність на роботі
батьків, які доглядають за дитиною. Крім того, гострі симптоми та часті рецидиви ГСО
вказують, що ГСО має суттєвий вплив на якість життя дітей і їх сімей.
За основу адаптованої клінічної настанови (АКН), заснованої на доказах, «Гострий середній
отит» було обрано сучасну американську настанову 2013 року Американської академії
педіатрії Clinical Practice Guideline. The diagnosis and management of acute otitis media.
Pediatrics.
Її доповнено японськими рекомендаціями 2015 року Clinical Practice Guideline for Diagnosis
and Management of Acute Otitis Media (AOM) in Children in Japan, італійськими
рекомендаціями 2010 року Acute otitis media: From diagnosis to prevention. і корейськими
рекомендаціями 2012 року Korean Clinical Practice Guidelines: Otitis Media in Children. У АКН
використано також матеріал з українських публікацій останніх років щодо ГСО.
Лікарі загальної практики-сімейні лікарі в більшості випадків є лікарями першого контакту
для пацієнтів з ГСО. Ця АКН буде відігравати істотну роль в навчанні лікарів загальної
практики-сімейних лікарів сучасним позиціям та робочій термінології, що призведе до
раціональної діагностики та обґрунтованого лікування, зокрема в закладах, що надають
первинну медичну допомогу. Всі прогалини доказової медицини, означені в АКН, зададуть
вектори діяльності для наших науковців.
Основною метою АКН є допомога практичному лікарю шляхом створення певних напрямків
для прийняття правильного вибору і уникання зайвих чи помилкових рішень. Запропоновану
АКН не слід розцінювати як сталий стандарт медичного лікування, а скоріше як мінімально
необхідний набір діагностично-лікувальних заходів. Настанови не замінюють клінічне
мислення і не можуть бути однозначними для усіх пацієнтів з усіма випадками ГСО.
Шаблонне дотримання положень АКН не гарантує успішного лікування в конкретному
випадку; її не можна розглядати як посібник, що включає всі необхідні методи діагностики
та лікування або виключає інші.
АКН може не давати поради щодо єдиного правильного підходу в конкретній ситуації.
Наприклад, за наявності у пацієнта супутньої патології враховують взаємно обтяжливий
вплив патологічних процесів і, відповідно, планують тактику ведення пацієнта. Остаточне
рішення стосовно вибору конкретної клінічної процедури або плану лікування повинен
приймати лікар з урахуванням клінічного стану пацієнта та можливостей для проведення
діагностики та лікування в конкретному закладі охорони здоров’я. В такому випадку обсяг і
порядок проведення діагностичних процедур та методів лікування може відрізнятися від
рекомендацій даної настанови.
Ця клінічна настанова має рекомендаційний характер.
8
THE DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA
РЕЗЮМЕ
Ця практична клінічна настанова на основі доказових даних є переглядом настанови
2004 року Американской академии педиатрии (AAP) та Американскої академії сімейних
лікарів «Гострий средній отит (ОСО)». Вона містить рекомендації для лікарів первинної
медичної допомоги щодо ведення дітей віком від 6-ти місяців до 12-ти років з
неускладненим ГСО.
У 2009 році AAP скликав комітет, що складається з лікарів первинної медичної допомоги і
спеціалістів з педіатрії, сімейної практики, отоларингології, епідеміології, інфекційних
хвороб, невідкладної медичної допомоги та методології створення настанов. Підкомітетом в
партнерстві з Агентством з досліджень та якості в сфері охорони здоров’я і Центром науково
обгрунтованої практики Південної Каліфорнії зроблено всеосяжний огляд нової літератури,
пов’язаної з ГСО, в часовому проміжку від першої публікації на основі доказових даних в
2000 р. Результуючий звіт доказових даних і інші джерела даних були використані для
розробки рекомендацій клінічної настанови.
Центр уваги цієї практичної настанови зосереджений на відповідній діагностиці і
початковому лікувані дитини з ГСО. В настанові наводиться специфіка, чітке визначення
(дефініція) ГСО. Вона розглядає питання ведення болю, початкове спостереження порівняно
антибіотикотерапією, відповідний вибір антибіотиків та профілактичні заходи. Також
розглядаються рекурентний ГСО, який не був включений в настанову 2004 року. Рішення
приймалися на основі систематичної класифікації якості доказів і відношення вигода/шкода.
Настанова пройшла всебічне незалежне оцінювання до офіційного затвердження AAP.
Ця клінічна настанова не є єдинним джерелом рекомендацій щодо ведення дітей з ГСО.
Швидше за все, вона призначена допомогти лікарям первинної медичної допомоги, надаючи
основу для прийняття клінічних рішень. Вона не призначена, щоб замінити клінічне
мислення або встановити протокол для всіх дітей з цією патологією. Ця настанова може не
забезпечити єдиного підходу до ведення пацієнтів з цією патологією
. Pediatrics 2013; 131:
e964-Е999. Ключовий практичний висновок 1А: лікарі-клініцисти мають діагностувати гострий
середній отит (ГСО) у дітей з випинанням барабанної перетинки (БП) середнього і важкого
ступеня вираженості чи вперше виявленими вушними гнійними виділеннями, які не
пов’язані з гострим зовнішнім отитом. Рівень доказовості: B. Ступінь: рекомендація.
Ключовий практичний висновок 1B: лікарі-клініцисти мають діагностувати ГСО у дітей з
легким випинанням БП та нещодавньою появою болю (менш як 48 годин) у вусі (або
невербальні аналоги отальгії) або значною гіперемією БП. Рівень доказовості: C. Ступінь:
рекомендація.
Ключовий практичний висновок 1С: лікарі-клініцисти не повинні діагностувати ГСО у
дітей, які не мають секрету в середньому вусі (згідно даних пневматичної отоскопії та/або
тимпанометрії). Рівень доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 2: лікування ГСО має включати оцінку болю. За
наявності больових відчуттів лікар має призначити терапію, що спрямована на їх
полегшення. Рівень доказовості: В. Ступінь: наполеглива рекомендація.
Ключовий практичний висновок 3А: тяжкий ГСО: лікар-клініцист повинен призначати
антибіотики (при одно- або двобічному ГСО) дітям від 6 місяців та старше за наявності таких
серйозних ознак чи симптомів, як помірна або тяжка оталгія протягом щонайменше 48
годин, температура тіла 39 °С чи вище. Рівень доказовості: В. Ступінь: наполеглива
рекомендація.
Ключовий практичний висновок 3B: нетяжкий двосторонній ГСО у маленьких дітей:
лікар-клініцист повинен призначати антибіотики при двобічному ГСО дітям віком 6–23
9
місяці без серйозних ознак чи симптомів (наприклад, легкої отальгії протягом щонайменше
48 годин та температури тіла нижче 39 °С). Рівень доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 3C: нетяжкий однобічний ГСО у маленьких дітей: при
однобічному ГСО у дітей віком 6-23 місяці без серйозних ознак чи симптомів (наприклад,
легкої отальгії протягом щонайменше 48 годин та температури тіла нижче 39 °С) лікар-
клініцист на основі спільного рішення з батьками/опікуном повинен призначати антибіотики
або вести ретельне динамічне спостереження стану здоров’я пацієнта. При виборі другого
варіанту слід упевнитися, що за умови відсутності покращення чи погіршення стану хвороби
протягом 48–72 годин після початку перших симптомів у дитини можна буде розпочати
антибіотикотерапію. Рівень доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 3D: нетяжкий ГСО у старших дітей: при одно-
/двобічному ГСО у дітей старше 24 місяців без серйозних ознак чи симптомів (наприклад,
легкої отальгії протягом щонайменше 48 годин та температури тіла нижче 39 °С) лікар-
клініцист на основі спільного рішення з батьками/опікуном повинен призначати антибіотики
або вести ретельне динамічне спостереження стану здоров’я пацієнта. При виборі другого
варіанту слід упевнитися, що за умови відсутності покращення чи погіршення стану хвороби
протягом 48-72 годин після початку проявів перших симптомів у дитини можна буде
розпочати антибіотикотерапію. Рівень доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 4А: якщо хворого з ГСО вирішено лікувати
антибіотиками, лікар-клініцист має призначати амоксицилін за умови, що дитина не має
факторів ризику резистентності (вік до 3 років, відвідування закладів із денним
перебуванням у групах дітей, наявність старших рідних брата/сестри, недавній прийом
антибіотика (до 1 місяця), не було антипневмококової вакцини, рецидив ГСО в анамнезі,
стійкий до дії амоксициліну), а також у пацієнтів, які мають синдром «отит-кон’юнктивіт».
Рівень доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 4B: якщо хворого з ГСО вирішено лікувати
антибіотиками, лікар-клініцист має призначити антибіотик з додатковим захистом від бета-
лактамаз за умови наявності у пацієнтів з факторами ризику резистентності (вік до 3 років,
відвідування закладів із денним перебуванням у групах дітей, наявність старших рідних
брата/сестри, недавній прийом антибіотика (до 1 місяця), не було антипневмококової
вакцини, рецидив ГСО в анамнезі, стійкий до дії амоксициліну), а також у пацієнтів, які
мають синдром «отит-кон’юнктивіт». Рівень доказовості: С. Ступінь: рекомендація.
Ключовий практичний висновок 4C: лікар-клініцист має повторно оцінити стан здоров’я
дитини, якщо особа, що наглядає за дитиною, повідомляє про погіршення стану хвороби або
відсутність терапевтичної відповіді на лікування антибіотиками протягом 48-72 годин, та
визначити необхідність зміни стратегії лікування. Рівень доказовості: В. Ступінь:
рекомендація.
Ключовий практичний висновок 5А: лікареві-клініцисту не слід призначати антибіотики з
профілактичною метою для зниження частоти розвитку ГСО у дітей з рецидивами хвороби.
Рівень доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 5B: за умови частих рецидивів ГСО (3 випадки за 6
місяців або 4 випадки на рік з 1 проявом за попередні 6 місяців) лікар-клініцист може
виконати тимпаностомію з введенням вентиляційного шунта. Рівень доказовості: В. Ступінь:
варіант вибору.
Ключовий практичний висновок 6А: всім дітям лікар-клініцист може рекомендувати
проводити щеплення антипневмококовою кон’югованою вакциною. Рівень доказовості: В.
Ступінь: наполеглива рекомендація.
Ключовий практичний висновок 6B: всім дітям лікар-клініцист може рекомендувати
проводити щорічне щеплення проти грипу. Рівень доказовості: В. Ступінь: рекомендація.
10
Ключовий практичний висновок 6C: лікарі-клініцисти мають заохочувати матерів до
проведення грудного вигодовування дитини протягом щонайменше 6 місяців. Рівень
доказовості: В. Ступінь: рекомендація.
Ключовий практичний висновок 6D: лікарі-клініцисти повинні рекомендувати уникнення
контакту дитини з димом від тютюнопаління. Рівень доказовості: С. Ступінь: рекомендація.
ВСТУП
У травні 2004 року ААР та AAFP опублікували «Клінічна практична настанова: діагностика і
лікування гострого середнього отиту».1 Документ містив 8 рекомендацій, класифікованих
відповідно до рівня доказовості та співвідношення шкоди/користі призначення. Три з них –
діагностичні критерії, спостереження та вибір антибіотика – спричинили суттєві дискусії,
особливо серед експертів у сфері середнього отиту (СО). На момент написання цієї
настанови наукові дані стосовно семивалентної пневмококової кон’югованої вакцини (PCV7)
ще не були опубліковані. Після створення рекомендацій в листопаді 2003 року та їх
публікації в травні 2004 року з’явилась значна кількість нових публікацій про ГСО.
В Сполучених Штатах Америки антибіотики дітям найчастіше призначають саме при СО2,3,
але за останні роки спостерігається скорочення кількості візитів таких пацієнтів до лікарні: з
950 на 1000 дітей в 1995-1996 до 634 на 1000 дітей в 2005-2006 роках. Відбулося
пропорційне зниження застосування антибіотиків при СО з 760 на 1000 дітей в 1995–1996 до
484 на 1000 дітей в 2005–2006 роках. Відсоткова кількість візитів хворих на СО до лікарні,
які потребували призначення антибіотиків, залишилася відносно сталою (80% в 1995–1996;
76% в 2005–2006)2. Зниженню показників відвідувань лікаря пацієнтів з СО сприяють багато
факторів, включаючи страхові випадки з необхідністю доплати коштів, що можуть
обмежувати візити до лікарні, кампанії по інформуванню громадськості щодо вірусної
природи більшості інфекційних захворювань, застосування пневмококової вакцини PCV7 та
ріст поширеності щеплення вакциною проти грипу. Лікарі-клініцисти повинні приділяти
більше уваги диференційній діагностиці ГСО та секректорного середнього отиту (ССО), що
призведе до зменшення статистики візитів до лікарні з приводу ГСО та кількості
призначення антибіотиків.
Незважаючи на суттєве публічне розголошення та розповсюдження Рекомендацій з ГСО
2004 року, докази свідчать, що лікарі-клініцисти неохоче дотримуються цих рекомендацій.
Vernaccio та співав.4 опитали 489 лікарів первинної допомоги щодо їх стратегії лікування 4
варіантів проявів ГСО, які були описані в настанові 2004 року. Під час оцінки відповідей не
виявили суттєвих змін у методах роботи лікарів порівняно з подібним анкетуванням,
виконаним до публікації рекомендацій ГСО 2004 року. Протягом 2002-2006 років Коко
(Coco)5 використовував опитувальник національної амбулаторної медичної допомоги з
метою визначення частоти візитів хворих з ГСО до лікарні, які не завершилися
призначенням антибіотиків, до видання настанови 2004 року та після видання. При цьому
жодної різниці показників не було зафіксовано. Подібну реакцію на публікацію
рекомендацій з лікування отиту також зафіксовано в Італії6,7. Отримані результати є дуже
схожими з даними інших досліджень щодо інформованості та дотримання керівних
рекомендацій лікарями всіх спеціальностей, в тому числі педіатрів8. Очевидно, що
ефективність клінічних практичних настанов залежить від їх поширеності та росту
показників дотримання.
В цьому перегляді та оновленні настанови з лікування ГСО ААР/ААFP 2004 року1 буде
оцінено опубліковані докази по діагностиці та терапії неускладненого ГСО, на їх основі
складатимуть рекомендації. Настанова призначена для лікарів первинної допомоги,
включаючи педіатрів, сімейних лікарів, лікарів невідкладної допомоги, ЛОР-лікарів,
фельдшерів і практикуючих медсестер. Документ охоплює рекомендації з діагностики та
лікування ГСО, в тому числі рецидивуючого ГСО і особливості терапії дітей віком від 6
місяців до 12 років. Ці настанови можна застосовувати лише у соматично здорових дітей без
11
супутніх захворювань, які можуть впливати на природній перебіг ГСО, наприклад, наявність
тимпаностомного вентиляційного шунта, кохлеарних імплантатів, вроджених вад розвитку (в
тому числі вовчої пащі); генетичних хвороб з аномаліями щелепно-лицьової ділянки
(синдром Дауна), імунодефіциту. Також настанова не поширюється на дітей з ССО без ГСО.
Словник термінів
ГСО – швидкий початок ознак та симптомів запалення середнього вуха9,10.
Неускладнений
ГСО
–
ГСО
без
отореї1,
а
також
без
отогенних
внутрішньочерепних/внутрішньовискових ускладнень.
Тяжкий ГСО – ГСО з наявністю помірної/тяжкої оталгії або гарячки 39°C чи вище9,10.
Нетяжкий ГСО – ГСО з наявністю легкої оталгії та температури тіла нижче 39°C9,10.
Рецидивуючий ГСО – 3 або більше задокументованих та окремих випадки ГСО за останні 6
місяців або 4 чи більше випадків за останні 12 місяців із щонайменше 1 випадком хвороби за
попередні 6 місяців 11,12.
ССО – запальний процес середнього вуха зі скупченням секрету (рідини); відсутність ознак
та симптомів гострої інфекції 9.
ССВ – наявність секрету (рідини) у середньому вусі; процес не має певної етіології,
патогенезу, патології чи тривалості 9.
Оторея – вушні виділення, що мають одне з наступних походжень: зовнішній слуховий хід,
середнє вухо, соскоподібний відросток, внутрішнє вухо або внутрішньочерепна порожнина.
Зовнішній отит – інфекція зовнішнього слухового ходу.
Тимпанометрія – вимірювання акустичного іммітансу вуха (передачі акустичної енергії) –
функції тиску повітря у вушному каналі. 13,14
Кількість хворих, яких необхідно лікувати (NNT) – кількість пацієнтів, яких слід лікувати
для попередження появи 1 додаткового негативного наслідку хвороби.15
Початкова антибактеріальна терапія – лікування ГСО антибіотиками, які призначають в
момент встановлення діагнозу з метою розпочати антибактеріальну терапію якомога швидше
після звернення хворого за медичною допомогою.
Первинне спостереження – початкова терапія ГСО, яка обмежується симптоматичним
лікування. Протимікробне лікування розпочинають відразу у випадках погіршення стану
дитини або якщо клінічне покращення не спостерігають через 48–72 годин після
встановлення діагнозу; слід налагодити механізм, який дозволить спостереження за станом
здоров’я дитини та призначити антибіотик за умови невдачі тактики спостереження.
МЕТОДИ
Розробка настанов на основі доказового методу потребує систематичного збору доказів,
виконання їх об’єктивної оцінки та опису таким чином, щоб читачі могли легко простежити
зв’язок між ними і наданою рекомендацією. Доказовий метод дозволяє розробити
твердження, які обґрунтовані якістю існуючого доказу та співвідношенням користі/шкоди їх
практичного впровадження. На рисунку 1 зображена залежність сили рекомендації від
доказу рівня доказовості і співвідношення користі/шкоди. В таблиці 1 наведені визначення
ААР та способи застосування різних типів доказових рекомендацій.16
Під час підготовки настанови 2004 року Агентство по дослідженням і якості медичного
обслуговування (AHRQ) фінансувало та провело вичерпний огляд літератури з діагностики
та лікування ГСО.17–19 В 2008 році AHRQ і Центр доказової медичної практики Південної
Каліфорнії розпочали схожий процес перегляду літературних джерел, що були видані з
моменту появи звіту AHRQ 2001 року. ААР знову співпрацювала з AHRQ та Центром
доказової медичної практики Південної Каліфорнії для створення доказового звіту, який
слугував основною базою даних для цих практичних керівних рекомендацій.20,21 Група
12
технічних експертів визначила нові ключові питання. Обсяги тематичного охоплення нового
звіту вийшли за межі публікації AHRQ 2001 року та включають рецидивуючий ГСО.
Перелік ключових запитань AHRQ у доповіді 2010 року:
1. Діагностика ГСО: якими є робочі характеристики (чутливість, специфічність,
коефіцієнт вірогідності) клінічних симптомів та результатів отоскопії (наприклад,
випинання БП) для діагностики неускладненого ГСО, диференційної діагностики з
ССО?
2. Який вплив семивалентної PCV7 на мікробну епідеміологію ГСО, які мікроорганізми
(бактерії і віруси) викликають ГСО після введення PCV7 та яка схема розвитку
антимікробної резистентності у хворих на ГСО після щеплення PCV7?
3. Яка порівняльна ефективність різних варіантів лікування неускладненого ГСО у
дітей групи середнього ризику?
4. Яка порівняльна ефективність різних варіантів лікування рецидивуючого СО
(неускладненого), персистуючого СО чи загострення ГСО?
5. Чи відрізняються результати лікування запитань 3 і 4 в залежності від
характеристики стану (ГСО), пацієнтів, навколишнього середовища та/або системи
надання медичної допомоги?
6. Які спостерігались побічні ефекти препаратів, що призначаються для терапії у
запитаннях 3 і 4?
Під час підготовки огляду 2010 року пошук в системі PubMed, базі даних систематичних
оглядів Кокрана (Cochrane Database of Systematic Reviews), Центральному реєстрі
контрольованих досліджень Кокрана (Cochrane Central Register of Controlled Trials) та
Інформаційному центрі навчальних ресурсів проводили за методикою звіту 2001 року для
публікацій з 1998 по червень 2010 року. Також в документ включені додаткові положення і
умови, що не розглядалися в огляді 2001 року (рецидивуючий СО, нові препарати та
семивалентна антипневмококова вакцина). Для пошуку цитат звіту 2001 року і його рецензій
також використовували систему «Web of Science». Заголовки публікацій незалежно один від
одного перевіряли два педіатри з досвідом виконання систематичних оглядів.
13
Рисунок 1. Залежність сили рекомендації від рівня доказовості і співвідношення
користі/шкоди. РКД – рандомізоване контрольоване дослідження.
Рівень доказовості
Перевага
користі
чи Баланс користі та шкоди
шкоди
А. Задовільний дизайн РКД
або
діагностичних Наполеглива рекомендація
досліджень для профільної
популяції.
B. РКД або діагностичні
дослідження з невеликими
Варіант вибору
обмеженнями; надзвичайно
узгоджені
докази
обсерваційних досліджень.
C. Обсерваційні (когортний
дизайн або за методом
«випадок-контроль»).
Рекомендація
D. Думка експертів, звіти
про клінічні випадки, які
Варіант вибору
обґрунтовуються першими
Рекомендація відсутня
джерелами.
Х. Виключні випадки, коли
Наполеглива рекомендація
спостерігається
чітка
перевага користі чи шкоди, а
підтверджувального
дослідження
провести Рекомендація
неможливо.
Таблиця 1. Визначення рекомендацій для доказових тверджень
Твердження
Визначення
Застосування
Наполеглива Наполеглива
рекомендація
на Лікарі-клініцисти
повинні
рекомендація користь виконання тієї чи іншої дії слідувати
наполегливим
робиться, коли очікувана користь рекомендаціям.
Виключення
втручання явно перевищує можливу становить
наявність
чітких
і
шкоду (наполеглива рекомендація переконливих
аргументів
на
проти
виконання
певної
дії користь альтернативного методу
робиться,
коли
передбачувана лікування.
шкода явно переважає користь), а
якість фундаментальних доказів є
відмінною. В деяких окремих
випадках
наполегливу
рекомендацію
дають,
якщо
неможливо отримати високоякісні
докази, але очікувана користь її
впровадження значно переважає
можливу шкоду.
Рекомендація Рекомендацію на користь виконання Лікарі-клініцисти повинні розумно
тієї чи іншої дії роблять, коли наслідувати рекомендації, але на
очікувана користь втручання явно практиці також враховувати нову
14
Твердження
Визначення
Застосування
перевищує можливу шкоду, але інформацію
та
побажання
якість доказів не є відмінною. В пацієнтів.
деяких чітко визначених випадках
рекомендацію
дають,
якщо
неможливо отримати високоякісні
докази, але очікувана користь її
впровадження суттєво переважає
можливу шкоду.
Варіант
Варіанти
вибору
визначають Лікарі-клініцисти
мають
вибору
можливі дії лікаря, коли якість враховувати
варіанти
вибору
доказів є сумнівною або ретельно лікування
під
час
прийняття
виконані
дослідження клінічних рішень, але в таких
демонструють невелику очевидну випадках
побажання
пацієнтів
перевагу одного методу лікування також можуть мати суттєву роль.
над іншим.
Рекомендація Відсутність рекомендацій вказує на Лікарі-клініцисти
мають
відсутня
відсутність
профільних відстежувати
появу
нових
опублікованих доказів, а також на опублікованих свідчень про баланс
те,
що
очікуваний
баланс користі/шкоди певної дії.
користі/шкоди наразі невідомий.
Для питань стосовно діагностики та ефективності лікування пошук проводився переважно
серед клінічних досліджень. Дані впливу антимпенвмококової вакцини на епідеміологію і
мікробіологію група експертів шукала у дослідженнях, які порівнювали мікробіологію
однакових популяцій хворих до та після проведення щеплення, або спостережних
дослідженнях, що оцінювали мікробіологію серед імунізованих та неімунізованих популяцій
пацієнтів.
Загалом експерти дослідили 7 646 заголовків публікацій, 686 з яких відібрали для
подальшого огляду. 72 статті, що відповідали попередньо визначеним критеріям включення і
виключення, вивчили детально. Дослідники підсумували дані в стандартні доказові таблиці,
їх точність перевірив сторонній дослідник. На основі встановлених критеріїв 2 дослідники
склали рейтинг якості клінічних досліджень. Для РКД використовували критерії Жадада
(Jadad)22, а критерії GRADE – для зведеного аналізу24. З метою оцінки досліджень, що
описували діагностику, застосовували критерії QUADAS23. Підсумовані дані включали
необхідні параметри для визначення груп дослідження, критеріїв включення/виключення,
впливових факторів та критеріїв ефективності результату. Деяку інформацію для проведення
аналізу вилучав біостатист, а її перевірку здійснював лікар-рецензент. Стратегію
послідовного прийняття рішень застосовували з метою співставлення та підсумовування
результатів скринінгу і перегляду двох педіатрів-рецензентів.
Під час оцінки ефективності лікування виконали зведений порівняльний аналіз, де могли
розглядати 3 або більше клінічних досліджень. Дослідження, які підходили для аналізу
питань стосовно ефективності терапії, розподілили на групи за методами лікування. Кожне
порівняння включало тільки ті дослідження, клінічна практика яких вважалася однорідною.
Оскільки деякі ключові питання розглядалися в доказовому звіті 2001 року17, до нових
знайдених статей звіту 2010 року були включені дослідження огляду 2001 року.20
Рішення приймали на основі систематичного оцінювання доказів рівня доказовості, сили
рекомендацій, а також висновків експертів за відсутності авторитетних даних. Результати
огляду літератури надані в таблицях доказів та опубліковані у фінальному доказовому звіті.20
У червні 2009 року ААР скликала новий підкомітет для оцінки і перегляду настанови з ГСО
від травня 2004 року1. Підкомітет складався з лікарів первинної допомоги, експертів в
15
області педіатрії, сімейної медицини, отоларингології, епідеміології, інфекційних хвороб,
невідкладної медицини і методології створеня настанов. Всі члени експертної групи
розглянули політику ААР з конфлікту інтересів та добровільного розкриття інформації, їм
була надана можливість представити будь-які потенційні конфлікти, пов’язані з роботою у
підкомітеті. Всі можливі конфлікти інтересів перелічені в кінці цього документу.
Фінансування проекту проводила ААР. Здійснюється постійна публікація нової літератури
про СО. Незважаючи на те, що систематичний огляд AHRQ неможливо тиражувати з
новинками літератури, члени Підкомітету з діагностики та лікування гострого середнього
отиту виконали оцінку додаткових публікацій. Кожні 6 місяців з червня 2009 по жовтень
2011 року в системі PubMed проводили пошук нових статей за єдиним запитом «гострий
середній отит». У підходящих публікаціях члени підкомітету оцінювали якість методології
та важливість результатів. Обрані статті використовували в огляді AHRQ, де також ще раз
перевіряли їх якість. Висновки приймали на основі консенсусу членів підкомітету після
перегляду нової літератури та повторної оцінки доказів AHRQ. Ключові практичні висновки
були отримані з використанням інтерактивного програмного забезпечення BRIDGE-Wiz
(побудова рекомендацій в редакторі розробників настанови), що виконує розробку клінічних
настанов на основі серії запитань, які призначені для створення більш дієвого набору
ключових практичних висновків.25 BRIDGE-Wiz також дозволяє включити якість існуючих
доказів до остаточного визначення сили кожної рекомендації.
Після виконання ретельного огляду цієї настанови членами підкомітету проект розглядали
інші комітети та підрозділи ААР, обрані сторонні організації та окремі особи, які були
призначені підкомітетом в якості експертів галузі. Крім того, членів підкомітету заохочували
до поширення проекту серед зацікавлених сторін їхньої лікарської спеціалізації. Усі
зауваження після розгляду робочою групою були за необхідністю включені до остаточної
версії настанови.
Ця практична клінічна настанова не призначена стати єдиним джерелом інформації щодо
лікування дітей з ГСО. Документ швидше адресований лікарям-клініцистам в якості
допомоги під час прийняття практичних рішень. Настанова не призначена замінити клінічну
оцінку хвороби або встановити протокол лікування всіх дітей з ГСО. В цій настанові може
бути відсутній єдиний правильний підхід до терапії даної патології.
Політика ААР передбачає здійснення перегляду та оновлення доказових даних настанов
кожні 5 років.
КЛЮЧОВІ ПРАКТИЧНІ ВИСНОВКИ
Ключовий практичний висновок 1А
Лікарі-клініцисти мають діагностувати гострий середній отит (ГСО) у дітей з
випианнням БП середнього і важкого ступеня тяжкості чи вперше виявленими
вушними гнійними виділеннями, які не пов’язані з гострим зовнішнім отитом. (Рівень
доказовості: B. Ступінь: рекомендація).
Профіль ключового практичного висновку: КПВ 1A
Сукупний рівень
Ступінь В
доказовості
Переваги
Визначає високу вірогідність отримання позитивного результату
втручання серед обраної популяції дітей
Уникнення призначення непотрібного лікування серед пацієнтів з
відсутністю очевидних ознак ГСО
Сприяє досягненню узгодженості під час діагностики
Ризики,
шкода, Може не враховувати ГСО, що проявляється у вигляді легкого
вартість
випинання БП, інтенсивної гіперемії чи отальгії. Такий стан не
16
обов’язково представляє легше захворювання, і тому хворий також
може отримати користь від проведеного втручання.
Оцінка
Переважання користі.
співвідношення
користі/шкоди
Оціночні судження
Важливим аспектом є виявлення популяції дітей з очевидними
ознаками ГСО. В кожному індивідуальному випадку допоміжним
фактором виступає встановлення точного і конкретного діагнозу.
Мета – зміна діючої практики гіпердіагностики захворювання.
Заохочується підвищення специфічності навіть за умови зниженої
чутливості.
Навмисна
Через використання жорстких діагностичних критеріїв не
невизначеність
розглядали зовнішній вигляд БП при легших захворюваннях, що
може бути раннім проявом ГСО.
Роль
побажань Відсутня
пацієнтів
Виключення
Відсутні.
Ступінь
Рекомендація
Примітки
Дослідження тимпаноцентезу підтвердили, що застосування цих
діагностичних висновків призводить до високого рівня виявлення
патогенних бактерій. Докази екстрапольовані з досліджень методів
лікування, які включають тимпаноцентез.
Ключовий практичний висновок 1B
Лікарі-клініцисти мають діагностувати ГСО у дітей з легким випинанням БП та
нещодавньою появою болю (менш як 48 годин) у вусі (або невербальні аналоги отальгії)
або значною гіперемією БП. (Рівень доказовості: C. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 1B
Сукупний
рівень Ступінь С
доказовості
Переваги
Виявлення ГСО у дітей, коли діагноз не є високодостовірним.
Ризики,
шкода, Гіпердіагностика ГСО. Зниження точності діагнозу.
вартість
Оцінка
Переважання користі.
співвідношення
користі/шкоди
Оціночні судження
Відсутні.
Навмисна
Критерії можуть бути більш суб’єктивними.
невизначеність
Роль
побажань Відсутня.
пацієнтів
Виключення
Відсутні.
Ступінь
Рекомендація
Примітки
Нещодавній початок вушного болю означає появу симптому в
17
межах останніх 48 годин.
Ключовий практичний висновок 1С
Лікарі-клініцисти не повинні діагностувати гострий середній отит (ГСО) у дітей, які не
мають виділення секрету в середньому вусі (згідно даних пневматичної отоскопії та/або
тимпанометрії). (Рівень доказовості: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 1C
Сукупний рівень
Ступінь В
доказовості
Переваги
Зменшення випадків гіпердіагностики та призначення непотрібного
лікування. Підвищення статистики правильної діагностики інших
хвороб із симптомами, які за інших обставин віднесли би до проявів
ГСО.
Сприяє
застосуванню
пневматичної
отоскопії
та
тимпанометрії з метою збільшення точності діагностики.
Ризики,
шкода, Вартість тимпанометрії. Деякі лікарі-клініцисти мають навчитися
вартість
або скоригувати власні навички проведення отоскопії та
тимпанометрії.
Оцінка
Переважання користі.
співвідношення
користі/шкоди
Оціночні судження
Відбувається гіпердіагностика ГСО, іноді навіть без достатньої
візуалізації БП. Є випадки початкового ГСО без наявності секрету,
але ризик гіпердіагностики є переважаючим.
Навмисна
Відсутня.
невизначеність
Роль
побажань Відсутня.
пацієнтів
Виключення
Початковий ГСО, який проявляється у вигляді інтенсивної гіперемії
БП.
Ступінь
Рекомендація
Мета цього розділу
Золотий стандарт діагностики ГСО відсутній. ГСО має цілий спектр проявів під час свого
розвитку.26 Метою цього розділу є надання лікарям-клініцистам та дослідникам робочого
клінічного визначення ГСО, відмінностей цього захворювання від ССО. Критерії обиралися
для досягнення високої специфічності, оскільки було зрозуміло, що зменшення чутливості
може призвести до виключення легших випадків ГСО.
Відмінності від настанови щодо ГСО ААР/AAFP 2004 року
Точний діагноз ГСО є дуже важливим для оголошення принципів клінічного мислення та
проведення високоякісних досліджень. В «Клінічній практичній настанові: діагностика та
лікування ГСО»1 2004 року застосовували визначення ГСО, яке складалося з 3 частин: (1)
гострий початок симптомів, (2) наявність ССВ та (3) ознаки гострого запалення середнього
вуха. Таке тлумачення хвороби викликало масштабні обговорення та повторний аналіз
діагностичних доказів ГСО. Документ 2004 року був недостатньо точним для виключення
випадків ССО, а діагноз ГСО міг бути встановлений у дітей з гострим початком симптомів,
включаючи тяжку отальгію і ССВ, без наявності інших отоскопічних ознак запалення.27 Крім
того, використання у настанові 2004 року «невизначеного діагнозу» дозволяло встановити
діагноз ГСО без чіткої візуалізації БП. В дослідженнях, які проводилися раніше, могли брати
18
участь діти, що вірогідніше мали ССО, ніж ГСО. Це могло призвести до статистики хибного
покращення стану цих дітей, оскільки неспецифічні симптоми їх захворювання
зменшувалися незалежно від проведеної терапії.28–30 В двох дослідженнях, опублікованих у
2011 році, використовували суворі діагностичні критерії для ГСО з набагато меншим
ризиком отримання висновків на основі пацієнтів з різними діагнозами.31,32
Після публікації настанови ГСО 2004 року було проведено цілу низку клінічних досліджень
для оцінки ступенів важкості симптомів. Ці дослідження не показали системної кореляції
симптомів з початковим діагнозом ГСО, особливо у дітей, які ще не вміють говорити.33–35
В останніх дослідженнях для досягнення поставленої мети застосовували чітко окреслені
суворі критерії діагностики ГСО.31,32 Діюча настанова схвалює використання точніших
отоскопічних діагностичних критеріїв в якості основи для прийняття клінічних рішень
(описано нижче). Під час застосування запропонованих жорстких критеріїв для діагностики
ГСО лікарі-клініцисти повинні мати на увазі, що у хворих на ГСО дітей з нещодавньою
появою болю у вусі в результаті отоскопії спостерігається лише інтенсивна гіперемія БП.
Коментар робочої групи: робоча група вважає за потрібне навести практичну
інформацію щодо методів обстеження, які застосовуються в Україні, при ГСО у дітей
(Косаковський А.Л., Юрочко Ф.Б. Середній отит. Міні-атлас. Київ-Львів-2016 – 50 стор.)
Об’єктивні методи обстеження та додаткові методи обстеження
Отоскопія (слуховий хід, вушна раковина, Додатково –
завушна ділянка, БП)
загальний аналіз крові з формулою
Отомікроскопія (за можливості)
аудіометрія, тимпанометрія (при
Отоендоскопія (за можливості)
зниженні слуху)
Пальпація/перкусія (натискання на козелок, КТ (при підозрі на внутрішньовискові
перкусія
завушної
ділянки)
Риноскопія ускладнення)
(порожнина носа, носоглотка, носові раковини, МРТ
(при
підозрі
на
носові ходи, перегородка носа)
внутрішньочерепні ускладнення)
Орофарингоскопія (слизова оболонка рота та Дослідження ліквору (при підозрі на
глотки, піднебінні мигдалики)
внутрішньочерепні ускладнення)
Симптоми ГСО
У старших дітей з ГСО зазвичай спостерігається швидкий початок вушного болю. Втім, у
маленьких
дітей,
які
ще
не
вміють
говорити,
про
оталгію
свідчить
смикання/розтирання/тримання
вуха,
надмірний
плач,
зміни
характеру
сну
(безсоння/неспокійний сон), відмова від їжі чи зміни поведінки дитини згідно повідомлень
батьків (наприклад, дратівливість, неспокій); перелічені ознаки часто є відносно
неспецифічними симптомами захворювання. У великій кількості клінічних досліджень
робили спробу корелювати ступеня тяжкості симптомів з діагнозом ГСО.
Коментар робочої групи: робоча група вважає за потрібне навести інформацію
щодо деяких клінічних проявів ГСО у дітей (Косаковський А.Л., Юрочко Ф.Б. Середній отит.
Міні-атлас. Київ-Львів-2016 – 50 стор.)
Скарги при ГСО у дітей
Специфічні
Неспецифічні
Біль вуха
Гарячка,
дратівливість,
зниження
Гноєтеча з вуха
апетиту, сонливість вдень, блювання,
Зниження слуху
пронос
Невербальне вираження болю вуха у малих дітей і немовлят
Неспокій,
дратівливість,
плач,
19
безсоння/неспокійний сон,
відмова від їжі,
дитина тягнеться рукою до вуха
Під час систематичного огляду36 виявлено 4 публікації з оцінками точності симптомів.37–40
Вушний біль відіграє важливу роль у діагностиці ГСО (комбінований позитивний коефіцієнт
вірогідності 3,0–7,3, негативний коефіцієнт вірогідності 0,4–0,6); але даний симптом
спостерігався лише у 50–60% дітей з ГСО. Висновки цих досліджень можуть бути
обмеженими, оскільки (1) до досліджень залучали дітей, які знаходилися під наглядом
фахівців і скоріше за все не представляли весь спектр тяжкості захворювання; (2) дослідники
використовували клінічний діагноз ГСО, що ґрунтувався більше на проявах патології, ніж на
тимпаноцентезі; (3) суб’єктами досліджень були здебільшого старші діти.37,40
Laine та співав.34 за допомогою анкети провели опитування 469 батьків, що мають дітей
віком 6–35 місяців і підозрюють наявність ГСО у своїх малюків. З усіх дітей у 237
діагностовано ГСО на основі жорстких отоскопічних критеріїв, 232 мали гостру
респіраторну інфекцію без ГСО. Такі ознаки, як неспокійний сон, потирання вуха, гарячка та
неспецифічні симптоми з боку травного тракту і дихальної системи не вказують на дітей з
наявністю чи відсутністю ГСО.
McCormick та співав.30 використовували 2 шкали симптомів – 3-пунктну (СО-3), що
складалася з симптомів фізичного дискомфорту, наприклад, вушний біль, гарячка, емоційний
стрес (дратівливість, поганий апетит), обмеження діяльності; і 5-пунктну (опитувальник
щодо симптомів групи лікування патології вуха [ETG-5]), яка об’єднувала гарячку, біль у
вухах, дратівливість, зниження апетиту, порушення сну. Ці шкали застосовували для оцінки
симптомів ГСО під час діагностики, а також кожного дня протягом 10-денного періоду
лікування чи спостереження. Обидва типи шкал виявилися чутливими до зміни клінічних
симптомів. Та ж группа35 досліджувала візуальну шкалу AOM-FS (ГСО-лицьова шкала), яка
є подібною до шкали болю Вонга-Бейкера41. Жодна з цих шкал не виявилася достатньо
чутливою до постановки діагнозу ГСО на основі симптомів. Комбінація AOM-FS з балами
отоскопії, OS-830, була представлена у вигляді двосторонньої кишенькової карти. Поєднання
AOM-FS і OS-8 вважалося більш чутливим до зміни симптомів, ніж кожен з цих
інструментів окремо.
Після появи жорстких вказівок Управління з санітарного нагляду за якістю харчових
продуктів та медикаментів США (FDA) щодо розробки шкал оцінки результату лікування на
основі відгуків пацієнтів Shaikh та співав.33,42 затвердили 7-пунктну шкалу симптомів дітей з
ГСО для проведення оцінки батьками (Шкала оцінки тяжкості симптомів гострого
середнього отиту [AOM-SOS]). Симптоми включали смикання/розтирання/тримання вуха,
дратівливість, труднощі засинання, зниження активності чи апетиту, гарячку. AOM-SOS
співвідносилася з отоскопічним діагнозом (ГСО, ССО та нормальний стан середнього вуха).
AOM-SOS змінюється відповідно до клінічних змін.
Коментар робочої групи: робоча група вважає за необхідне навести інформацію
щодо можливих ускладнень ГСО та їх клінічних проявів.
Ускладнення ГСО
Внутрішньочерепні
епідуральний абсцес
перісинуозний абсцес
тромбоз сигмоподібного або сигмоподібного та поперечного
синусів
субдуральний абсцес
абсцес мозку
менінгіт
отогенна гідроцефалія
Внутрішньовискові
отоантрит
мастоїдит
20
парез лицевого нерва
петрозит
лабіринтит
Сепсис
тромбоз сигмоподібного або сигмоподібного та поперечного
синусів
Симптоми ускладнень ГСО
Симптом
Потенційне ускладнення
Набряки біля вуха
Мастоїдит, отоантрит
Болючість при перкусії соскоподібного Мастоїдит, отоантрит
відростка
Відстовбурчення вушної раковини
Мастоїдит, отоантрит
Згладженість завушної складки
Мастоїдит, отоантрит
Асиметрія обличчя
Парез лицевого нерва
Неврологічні
симптоми:
блювання, Внутрішньочерепні ускладнення (менінгіт,
ригідність потиличних м’язів, головний біль, абсцес тощо).
порушення рівноваги, запаморочення
Лабіринтит
Ознаки ГСО
В декількох дослідженнях оцінювали зв’язок результатів отоскопії при ГСО та
тимпаноцентезу. На дослідження, проведене Karma та співав.,43 часто посилаються як на
найкраще єдине дослідження результатів отоскопії при ГСО. Проте, в дослідженні
застосовується лише діагностика ГСО на основі симптомів плюс наявність ССВ. Таким
чином, діти з гострими симптомами інфекції верхніх дихальних шляхів та ССО могли
розглядатися як такі, що мають ГСО. Також існують суттєві відмінності у результатах,
отриманих у двох центрах, які брали участь у дослідженні.
Дослідники зіставляли колір, рухомість та положення БП з присутністю секрету у
середньому вусі, отриманої при тимпаноцентезі. У двох центрах у Фінляндії (Тампере та
Оулу) за 2 911 дітьми спостерігали з 6-місячного віку до 2,5 років. Один отоларинголог у
місті Тампере та один педіатр у місті Оулу обстежували пацієнтів. Реєструвалися колір,
положення та рухомість. Проводили міринготомію та аспірацію, якщо була підозра на ССВ.
ГСО діагностували, якщо виявляли ССВ і у дитини була гарячка, біль у вусі, підвищена
збудливість, дитина потирала вухо або тягнула за нього, одночасні інші гострі симптоми з
боку дихальних шляхів, блювання або діарея. Присутність або відсутність ССВ реєстрували,
але не проводили аналізу рідини, у тому числі посівів. Результати пневматичної отоскопії
класифікувалися наступним чином: колір – геморагічний, дуже червоний, помірно червоний,
мутний або тьмяний, світло-червоний або нормальний; положення – випинання, втягнення
або норма; та рухомість – різко порушена, слабко порушена або нормальна.
Для цього аналізу було доступно 11 804 візити. Для візитів з гострими симптомами, ССВ
було виявлено у 84,9% та 81,8% у двох центрах, в яких проводили дослідження. Була суттєва
відмінність між результатами, отриманими у двох центрах, які були залучені до дослідження.
В Таблиці 2 показані специфічні дані для кожного результату.
Таблиця 2. Результати отоскопії у дітей з гострими симптомами та ССВ
Результати обстеження БП Група І
Група ІІ
під час візитів з гострими (Тампере, Фінляндія),
(Оулу, Фінляндія),
симптомами та ССВ
%
%
Колір
Різко червоний
69,8
65,6
Геморагічний
81,3
62,9
21
Дуже червоний
87,7
68,1
Помірно червоний
59,8
66,0
Світло-червоний
39,4
16,7
Мутний
95,7
80,0
Нормальний
1,7
4,9
Положення
Випинання
96,0
89
Втягнення
46,8
48,6
Норма
32,1
22,2
Рухомість
Різко порушена
94,0
78,5
Слабко порушена
59,7
32,8
Нормальна
2,7
4,8
аСумарне значення більше за 100%, оскільки для кожного вуха могли бути отримані різні
результати.43
Комбінація «мутного» кольору, випинання БП з порушеною рухомістю була найкращим
предиктором ГСО при застосуванні діагностики на основі симптомів у цьому дослідженні.
Порушена рухомість мала найвищу чутливість та специфічність (приблизно 95% та 85%,
відповідно). Помутніння було найкращою наступною комбінацією високої чутливості
(~74%) та високої специфічності (~93%) у цьому дослідженні. Випинання мало високу
специфічність (~97%), але нижчу чутливість (~51%). БП, яка була геморагічною, дуже
червоною або помірно червоною, також зіставлялася з присутністю ГСО, а БП, яка була
лише «світло-червоною», не могла допомогти у діагностичному плані.
Mc Cormic та співав. повідомили, що випинання БП було сильно пов’язаним з присутністю
бактеріального збудника, з одночасною присутністю вірусного збудника або без.44 У
невеликому дослідженні 31 дитині (40 вух) зробили міринготомію.45 При випинанні БП був
позитивний посів на бактерії у 75% випадків. Відсоток позитивних посівів на патоген
збільшувався до 80%, якщо колір БП був жовтим. Висновок полягає у тому, що помірне або
сильне випинання БП представляє собою найбільш важливу характеристику при діагностиці
ГСО – результат, який має значення для надання клінічної допомоги, дослідження та
навчання. Комітет визнав, що є перехід від присутності ССВ до випинання БП, і часто важко
диференціювати цей сумнівний зовнішній вигляд від безсумнівних критеріїв ГСО, що
рекомендуються цією настановою.26 Таким чином, має значення індивідуалізована
постановка діагнозу та рішення про лікування. Приклади нормального положення, слабкого
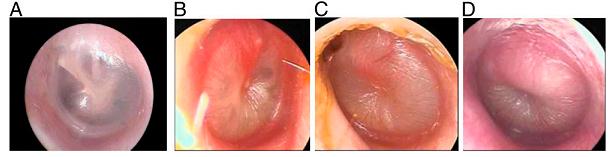
випинання, помірного випинання та сильного випинання можна побачити на Рис.2.
Відмінність між ГСО та ССВ
ССВ може виникати як наслідок епізоду ГСО або як наслідок порушення функції слухової
труби, пов’язаного з інфекцією верхніх дихальних шляхів.46 Проте, ССВ також може
передувати та провокувати розвиток ГСО. Ці дві форми СО можуть розглядатися як
сегменти неперервної ланцюжка захворювання.47 Тим не менше, оскільки ССО не
представляє собою гострий інфекційний процес, при якому лікування антибіотиками дає
позитивний результат, для лікарів-клініцистів дуже важливо майстерно оволодіти здатністю
відрізняти нормальний стан середнього вуха від ССВ або ГСО. Це допоможе уникнути
непотрібного застосування антибіотиків, яке призводить до підвищення частоти побічних
ефектів лікарського засобу та сприяє розвитку резистентності до протимікробних препаратів.
22
Обстеження БП
Точна діагностика ГСО у новонароджених та маленьких дітей може бути складною.
Симптоми можуть бути легкими або співпадати з симптомами захворювання верхніх
дихальних шляхів. БП може бути перекрита сірковою пробкою, і може бути важко
роздивитися незначні зміни БП. Додаткові фактори, які ускладнюють діагностику, можуть
включати відсутність контакту з дитиною; недостатню кількість діагностичного обладнання,
включаючи відсутність нагнітального балона отоскопа; неналежні інструменти для
видалення сіркової пробки із зовнішнього слухового каналу; неналежну допомогу при
заспокоюванні дитини; та брак досвіду видалення сірчаного корка та проведення
пневматичної отоскопії.
Пневматичний отоскоп – це стандартний інструмент, який застосовується при діагностиці
СО. Також цінність має хірургічна голівка, яка сприяє видаленню сірчаного корка із
зовнішнього слухового каналу новонародженого. Сірку можна видалити за допомогою
кюретки, обережного відсмоктування або вимивання.48 Пневматичний отоскоп повинен мати
джерело світла достатньої яскравості та герметичне ущільнення, яке дозволяє застосовувати
позитивний та негативний тиск. Загалом, багаторазові вушні лійки досягають кращої
герметичності, викликаючи менше больових відчуттів, завдяки тоншим, рівнішим краям та
кращій світлопропускній здатності. Розмір вушних лійок необхідно вибирати для
забезпечення обережного герметичного закриття зовнішньої частини зовнішнього слухового
ходу.
Пневматична отоскопія дозволяє оцінити контур БП (нормальний, із западанням, повний, із
випинанням), її колір (сірий, жовтий, рожевий, бурштиновий, білий, червоний, синій) та її
прозорість (прозора, напівпрозора, непрозора) та її рухомість (нормальна, підвищена,
знижена, відсутня). Нормальна БП напівпрозора, перламутрово-сіра (рис. 2А). Можуть бути
візуалізовані специфічні розпізнавальні точки. До них відноситься короткий відросток та
руків’я молоточка, а також ненатягнута частина БП, яка розміщена вище. Їх легко помітити, і
вони допомагають ідентифікувати положення БП. При пневматичній отоскопії повинен
виникати рух БП у зовнішньому ході досередини при позитивному тиску та рух назовні при
негативному тиску, особливо у задньо-верхньому квадранті. Коли БП втягнута, короткий
відросток молоточка більше виступає, а руків’я здається коротшим через зміну її положення
у середньому вусі. Рух досередини, який виникає під позитивним тиском, обмежений або
відсутній, оскільки БП часто втягнена досередини настільки, наскільки їй дозволяє об’єм
рухів. Тим не менше, рухомість назовні можна візуалізувати при застосуванні негативного
тиску. Якщо БП не створює помітного руху при застосуванні обережного позитивного або
негативного тиску, швидше за все, є ССВ. Іноді застосування тиску буде створювати
помітнішу поверхню розділення повітря-рідина позаду БП (що є діагностичною ознакою
ССВ).49
Навчання правильній оцінці стану середнього вуха дитини повинно починатися під час
першого циклу педіатрії у медичному інституті і продовжуватися протягом усього курсу
спеціалізації.50
23
Рисунок 2
А. Нормальна БП. В. БП із легким випинанням. С. БП із помірним випинанням. D. БП із
сильним випинханням. З особистого архіву Алехандро Хобермана (Alejandro Hoberman),
доктора медицини.
Коментар робочої групи: робоча група вважає за потрібне навести інформацію
щодо критеріїв діагнозу ГСО у дітей. До них слід віднести:
1) гострий початок (до 3-х тижнів);
2) наявність випоту в середньому вусі [≥1 отоскопічний симптом (видимий
випіт/рідина, зміни світлового рефлексу, тьмяність БП, випинання БП);
3) запалення БП (принаймні середньої тяжкості або виражене);
4) ≥1 специфічний симптом (оталгія, зниження слуху, гіперемія, перфорація БП);
5) ≥1 неспецифічний симптом (гарячка, дратівливість, зниження апетиту,
сонливість, блювання, пронос).
Для діагностики ГСО у пацієнта необхідна наявність усіх п’яти критеріїв.
Безперервна медична освіта повинна підсилити важливість та підвищити кваліфікацію
лікаря-клініциста у застосуванні пневматичної отоскопії.51 Засоби підготовки включають
застосування відеоотоскопа у програмах ординатури, застосування учбових матеріалів на
веб-основі,49,52 а також одночасне або поетапне обстеження БП разом із кваліфікованим
спеціалістом з отоскопії для підтвердження результатів, шляхом застосування отоскопа з
двома голівками або відеоотоскопа. Засоби для вивчення процедури обстеження вуха можна
знайти на CD-дисках, які поширює медичний факультет Університету Джонса Хопкінса та
Інститутом навчання середнього медичного персоналу Джонса Хопкінса,53 і які також можна
знайти за адресою
http://www2.aap.org/sections/infectdis/video.cfm 54 та через програму на веб-
основі ePROM: Підвищення кваліфікації при середньому отиті.52
Ключовий практичний висновок 2
Лікування ГСО має включати оцінку болю. За наявності больових відчуттів лікар має
призначити терапію, що спрямована на їх полегшення. (Рівень доказовості: В. Ступінь
рекомендації: наполеглива рекомендація)
Профіль ключового практичного висновку: КПВ 2
Сукупний
рівень Ступінь В
доказовості
Переваги
Послаблює основні симптоми ГСО.
Ризики,
шкода, Потенційні побічні ефекти лікарського засобу. Варіабельна
вартість
ефективність деяких режимів лікування.
Оцінка
Переважання користі.
співвідношення
користі/шкоди
24
Оціночні судження
Лікування болю є основним незалежно від призначення
антибіотиків.
Навмисна
Вибір анальгетика не встановлено.
невизначеність
Роль
побажань Батьки можуть допомагати у прийнятті рішення щодо того, яким
пацієнтів
засобам зняття болю вони нададуть перевагу.
Виключення
Місцеві анальгетики при перфорованій БП.
Ступінь
Наполеглива рекомендація
Мета цього розділу
Біль – це основний симптом ГСО. Цей розділ розглядає та надає актуальну літературу щодо
лікування оталгії.
Відмінності від настанови щодо ГСО ААР/AAFP 2004 року
Лише 2 нові статті безпосередньо розглядають лікування отальгії. Обидві статті розглядають
місцеве лікування. Дві нові статті відповідають твердженням настанови. Таким чином, тут
відтворений текст настанови 2004 року, із додаванням обговорення двох нових статей.
Таблиця 3 була оновлена включенням нових посилань.
Лікування отальгії
Багато епізодів ГСО супроводжуються болем.55 Деякі діти з ССО також страждають від болю
у вусі. Хоча біль – це типовий симптом при таких захворюваннях, лікарі-клініцисти часто
вбачають в отальгії неосновну проблему, яка не потребує безпосередньої уваги.56 Біль, який
пов’язується з ГСО, може бути дуже сильним у перші декілька днів захворювання, і часто
може тривати довше у маленьких дітей.57 Лікування ГСО антибіотиками не забезпечує
симптоматичного полегшення у перші 24 години,58–61 і навіть через 3–7 днів у 30% дітей
молодше 2 років може існувати персистуючий біль, гарячка або обидва симптоми разом.62 З
іншого боку, анальгетики дійсно полегшують біль, пов’язаний з ГСО, протягом 24 годин, і їх
необхідно застосовувати незалежно від призначення антибіотикотерапії; їх слід
продовжувати застосовувати стільки, скільки це буде необхідно. AAP опублікувала
твердження програмних принципів «Оцінка та лікування гострого болю у новонароджених,
дітей та підлітків»,64 щоб допомогти лікарям-клініцистам боротися з болем в контексті
захворювання. Лікування болю, особливо, протягом перших 24 годин епізоду ГСО, повинно
розглядатися незалежно від застосування антибіотиків.
Застосовувалися різноманітні методи лікування оталгії, але жоден з них не був достатньо
вивчений. Лікар-клініцист повинен вибрати лікування на основі розгляду питання про
користь та шкоду, а також, якщо можливо, поєднати вподобання батьків/опікуна та пацієнта
(Таблиця 3).
Таблиця 3. Лікування отальгії при ГСО
Метод лікування
Коментарі
Ацетамінофен, ібупрофен (63)
Ефективна анальгезія легкого та помірного
болю.
Загальнодоступні. Основа для лікування
болю при ГСО.
Народні засоби (відсутні контрольовані Можуть мати обмежену ефективність.
дослідження, які безпосередньо розглядають
ефективність)
Відволікання
25
Метод лікування
Коментарі
Прикладання тепла або холоду ззовні
Олійні краплі у зовнішній слуховий канал
Місцеві засоби
Бензокаїн, прокаїн, лідокаїн (65, 67, 70)
Додаткова, але короткочасна користь у
порівнянні з ацетамінофеном у пацієнтів
старше 5 років.
Натуропатичні засоби (68)
Можна
порівняти
з
краплями
аметокаїну/феназону у пацієнтів старше
6 років.
Гомеопатичні засоби (71, 72)
Відсутні контрольовані дослідження, які
безпосередньо розглядають біль.
Наркотичні анальгетики з кодеїном або Ефективні при помірному та сильному
аналогами
болю.
Необхідний
рецепт;
ризик
пригнічення
дихання,
порушення
психічного стану, розлад з боку шлунково-
кишкового тракту та закреп.
Тимпаностомія/міринготомія (73)
Вимагає навичок та має потенційні ризики.
Після публікації настанови у 2004 році було лише дві нові важливі публікації.
Bolt та співав. повідомили у 2008 році про подвійне сліпе плацебо-контрольоване
дослідження, проведене у 2003-2004 роках у відділенні інтенсивної терапії Дитячої лікарні
Австралії.65 Вони застосовували не репрезентативну вибірку дітей віком від 3 до 17 років з
діагнозом ГСО у відділенні інтенсивної терапії. Вони виключили дітей з перфорацією БП,
вентиляційним вушним шунтом, алергією на місцеві анестетики або парацетамол, епілепсією
або хворобами печінки, нирок або серця. Шістдесят три дитини, придатні для включення,
були рандомізовані для отримання лідокаїну на водній основі або вушних крапель на основі
фізіологічного розчину до 3 разів за добу. Вони продемонстрували статистично достовірне
50% зменшення повідомленого болю через 10 та 30 хвилин, але не через 20 хвилин після
місцевого застосування лідокаїну у порівнянні з фізіологічним розчином. Ускладнення були
мінімальними: 3 дитини повідомили про запаморочення на наступний день, і жоден з дітей
не повідомив про шум у вухах. Обмеження полягало у тому, що деякі діти перорально
отримували ацетамінофен перед застосуванням вушних крапель.
Кокранівський огляд місцевого знеболення при ГСО66 проводив пошук в Кокранівському
реєстрі контрольованих досліджень, РКД або квазі-РКД, які порівнювали вушні препарати з
плацебо, або які порівнювали між собою 2 вушних препарати. Сюди відносяться
дослідження серед дорослих та дітей без перфорації БП.
Він ідентифікував 5 досліджень у дітей віком від 3-ти до 18-ти років. Два з них (включаючи
дослідження Bolt та співав.,65 яке обговорювалося вище) порівнювали знеболювальні краплі
та плацебо при ГСО. В обох дослідженнях деякі діти також отримували пероральні
анальгетики. Ці дослідження порівнювали знеболювальні вушні краплі з натуропатичними
краплями рослинного походження. Натуропатичні краплі мали позитивний ефект через 15–
30 хвилин після застосування і через 1–3 дні після встановлення діагнозу, але різниця не була
статистично достовірною. Кокранівська група зробила висновок про те, що є обмежені
докази ефективності вушних крапель через 30 хвилин і незрозуміло, чи результати цих
досліджень є результатами природного перебігу хвороби, ефектом плацебо внаслідок
проведення лікування, пом’якшуючим ефектом будь-якої рідини у вусі або ефектом крапель
26
самих по собі. На три дослідження, включені до цього огляду, було посилання у настанові
AAP 2004 року,67–69 і посилання на одну нову статтю було у Bolt та співав.65
Ключовий практичний висновок 3А
Тяжкий ГСО
Лікар-клініцист повинен призначати антибіотики (при одно- або двобічному ГСО)
дітям від 6 місяців та старше за наявності таких серйозних ознак чи симптомів, як
помірна або тяжка отальгія, або отальгія протягом щонайменше 48 годин, або
температура тіла 39 °С чи вище. (Рівень доказовості: В. Ступінь рекомендації:
наполеглива рекомендація)
Профіль ключового практичного висновку: КПВ 3А
Сукупний
рівень Ступінь В
доказовості
Переваги
Збільшена вірогідність швидшого зникнення симптомів. Збільшена
вірогідність припинення ГСО.
Ризики,
шкода, Побічні ефекти, пов’язані з антибіотиками, такі як діарея,
вартість
пелюшковий дерматит та алергічні реакції. Надмірне використання
антибіотиків
призводить
до
підвищення
бактеріальної
резистентності. Вартість антибіотиків.
Оцінка
Переважання користі над шкодою.
співвідношення
користі/шкоди
Оціночні судження Відсутні.
Роль
побажань Відсутня.
пацієнтів
Навмисна
Відсутня.
невизначеність
Виключення
Відсутні.
Ступінь
Наполеглива рекомендація
Ключовий практичний висновок 3B
Не тяжкий двобічний ГСО у маленьких дітей
Лікар-клініцист повинен призначати антибіотики при двобічному ГСО дітям віком
молодше 24 місяців без проявів серйозних ознак чи симптомів (наприклад, легкої
отальгії протягом менше ніж 48 годин та температури тіла нижче 39 °С). Рівень
доказовості: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 3B
Сукупність якості
Ступінь В
доказів
Переваги
Збільшена вірогідність швидшого зникнення симптомів. Збільшена
вірогідність припинення ГСО.
Ризики,
шкода, Побічні ефекти, пов’язані з антибіотиками, такі як діарея,
вартість
пелюшковий дерматит та алергічні реакції. Надмірне використання
антибіотиків
призводить
до
підвищення
бактеріальної
резистентності. Вартість антибіотиків.
27
Оцінка
Переважання користі над шкодою.
співвідношення
користі/шкоди
Оціночні судження
Відсутні.
Роль
побажань Відсутня.
пацієнтів
Навмисна
Відсутня.
невизначеність
Виключення
Відсутні.
Ступінь
Рекомендація
Ключовий практичний висновок 3C
Нетяжкий однобічний ГСО у маленьких дітей
Нетяжкий однобічний ГСО у маленьких дітей: при однобічному ГСО у дітей віком 6-23
місяці без серйозних ознак чи симптомів (наприклад, легкої отальгії протягом
щонайменше 48 годин та температури тіла нижче 39 °С) лікар-клініцист на основі
спільного рішення з батьками/опікуном повинен призначати антибіотики або вести
ретельне динамічне спостереження стану здоров’я пацієнта. При виборі другого
варіанту слід упевнитися, що за умови відсутності покращення чи погіршення стану
хвороби протягом 48–72 годин після початку перших симптомів у дитини можна буде
розпочати антибіотикотерапію. (Рівень доказовості: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 3C
Сукупний рівень
Ступінь В
доказовості
Переваги
Помірно більша вірогідність швидшого зникнення симптомів при
початковому
застосуванні
антибіотиків.
Помірно
більша
вірогідність припинення ГСО при початковому застосуванні
антибіотиків.
Ризики,
шкода, Побічні ефекти, пов’язані з антибіотиками, такі як діарея,
вартість
пелюшковий дерматит та алергічні реакції. Надмірне використання
антибіотиків
призводить
до
підвищення
бактеріальної
резистентності. Вартість антибіотиків.
Оцінка
Помірний ступінь переважання користі над шкодою.
співвідношення
користі/шкоди
Оціночні судження
Спостереження стає альтернативою при досягненні балансу між
користю та шкодою.
Роль
побажань Прийняття спільного рішення з батьками є ключовим моментом
пацієнтів
перед вибором спостереження.
Навмисна
Прийняття спільного рішення з батьками дуже відрізняється у
невизначеність
різних сім’ях.
Виключення
Відсутні.
Ступінь
Рекомендація
Примітки
На думку одного з членів підкомітету, бажаним є протимікробне
28
лікування цих дітей через переважання користі над шкодою. Це
член підкомітету не узгоджував ключовий практичний висновок 3C
Ключовий практичний висновок 3D
Нетяжкий ГСО у старших дітей
При одно-/двобічному ГСО у дітей старше 24 місяців без серйозних ознак чи симптомів
(наприклад, легкої отальгії протягом щонайменше 48 годин та температури тіла нижче
39 °С) лікар-клініцист на основі спільного рішення з батьками/опікуном повинен
призначати антибіотики або вести ретельне динамічне спостереження стану здоров’я
пацієнта. При виборі другого варіанту слід упевнитися, що за умови відсутності
покращення чи погіршення стану хвороби протягом 48-72 годин після початку проявів
перших симптомів у дитини можна буде розпочати антибіотикотерапію. (Рівень
доказововсті: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 3D
Сукупний рівень
Ступінь В
доказовості
Переваги
Початкова антибіотикотерапія: Дещо більша вірогідність швидшого
зникнення симптомів; дещо більша вірогідність припинення ГСО.
Початкове спостереження: Зменшене застосування антибіотиків;
зменшення побічних ефектів антибіотиків; зменшений потенціал
розвитку бактеріальної резистентності.
Ризики,
шкода, Початкова антибіотикотерапія: Побічні ефекти, пов’язані з
вартість
антибіотиками, такі як діарея, висип та алергічні реакції. Надмірне
використання антибіотиків призводить до підвищення бактеріальної
резистентності. Початкове спостереження: Можливо, буде потреба
розпочати застосування антибіотиків через 48-72 години, якщо у
пацієнта не зникають симптоми. Мінімальний ризик побічних
наслідків
відтермінованої
антибіотикотерапії.
Потенційне
збільшення телефонних викликів та візитів лікаря.
Оцінка
Слабкий
ступінь
переважання
користі
початкової
співвідношення
антибіотикотерапії над шкодою.
користі/шкоди
Оціночні судження
Спостереження є варіантом при досягненні балансу між користю та
шкодою.
Роль
побажань Прийняття спільного рішення з батьками є ключовим моментом
пацієнтів
перед вибором спостереження.
Навмисна
Прийняття спільного рішення з батьками дуже відрізняється у
невизначеність
різних сім’ях.
Виключення
Відсутні.
Ступінь
Рекомендація
Мета цього розділу
Мета цього розділу полягає у наданні керівництва стосовно початкового лікування ГСО,
допомагаючи лікарям-клініцистам вибрати між наступними двома стратегіями:
1.
Початковою антибіотикотерапією, яку визначають як лікування ГСО
антибіотиками, які призначають на момент діагностики з наміром почати
антибіотикотерапію якомога швидше після виявлення.
29
2.
Початковим спостереженням, яке визначають як початкове лікування ГСО, що
обмежується симптоматичним лікуванням, з початком антибіотикотерапії лише у
випадку, якщо стан дитини погіршується у будь-який час, або нема клінічного
покращення протягом 48-72 годин з моменту встановлення діагнозу. Повинні бути
створені умови, які забезпечать спостереження та початок антибіотикотерапії, якщо
режим спостереження за дитиною буде неефективним.
В цьому розділі припускають, що лікар-клініцист встановив точний діагноз ГСО за
допомогою критеріїв та стратегій, висвітлених вище у цій настанові. Інше припущення
полягає в тому, що проведене чітке розмежування між роллю анальгетиків та антибіотиків у
забезпеченні полегшення симптомів у дітей з ГСО.
Зміни до попередньої клінічної настанови з лікування ГСО
В клінічній настанові з лікування ГСО, розробленій AAP та AAFP, вперше в Північній
Америці було запропоновано «варіант спостереження» для деяких дітей з ГСО, приймаючи
до уваги успішну реалізацію подібної практики в штаті Нью Йорк74 та застосування такої
парадигми в багатьох країнах Європи. Спільною рисою обох підходів була пріоритетна
початкова антибіотикотерапія при точно встановленому діагнозі та більший акцент на
спостереженні при невизначеному діагнозі. У відповідь на критику, що допускання
«невизначеного діагнозу» може стати виправданням для неповної візуалізації БП або
невідповідного використання антибіотиків, таку класифікацію було скасовано з тим, щоб
більша увага приділялася максимальній точності діагностування ГСО.
З часу опублікування попередньої клінічної настанови з лікування ГСО було проведено нові
дослідження щодо початкового лікування ГСО, в тому числі РКД антибіотикотерапії в
порівнянні з плацебо або відсутністю терапії,31,32,75 дослідження негайної антибіотикотерапії
проти відтермінованої,30,76,77 або відтермінованої антибіотикотерапії із супутнім
призначенням лікування або без нього.78 Особливо важливі статті Хобермана і Техтінена
(Hoberman and Tähtinen), оскільки в них визначені чіткі критерії діагностування ГСО.31,32
Публікувались систематичні огляди щодо відтермінованої антибіотикотерапії,79 перебігу
ГСО у нелікованих дітей,57 прогностичних факторів щодо користі антибіотиків,62 дії
антибіотиків на безсимптомний ССО після лікування.80 Обсерваційні дослідження надали
додаткових даних щодо результатів первинного спостереження з відтермінованою
антибіотикотерапією (при необхідності) 81 та зв’язку попередньої антибіотикотерапії ГСО з
подальшим гострим мастоїдитом. 82,83
На відміну від попередньої настанови з лікування ГСО,1 в якому рекомендувалася
антибіотикотерапія для всіх дітей віком від 6 місяців до 2-х років із встановленим діагнозом,
оновлена настанова дає можливість вибору між початковою антибіотикотерапією та
первинним спостереженням для дітей зазначеної вікової групи з одностороннім ГСО та
помірними симптомами, але тільки після спільного прийняття рішення з батьками/опікунами
(Таблиця 4). Така зміна обґрунтовується доказами безпечності спостереження або
відтермінованого призначення лікування маленьким дітям. 30,31,32,75,76,81 У випадках, коли
спостереження не дає результатів, повинен бути задіяний механізм забезпечення подальшого
нагляду та початку застосування антибіотиків.
Важливість точного діагностування
Рекомендації щодо лікування ГСО передбачають встановлення точного діагнозу на основі
критеріїв, викладених в розділі «Діагностика» цих настанов. З часу розробки в 2004 році
клінічної настанови AAP/AAFP щодо лікування ГСО було проведено багато досліджень з
використанням чіткіших діагностичних визначень ГСО, ніж ті, що застосовували раніше.
Для діагностики ГСО у більшості дітей, яких включали в сучасні дослідження, необхідним
критерієм вважалось випинання БП.31,32 Застосовуючи критерії, викладені в цій настанові,
лікарі-клініцисти зможуть точніше розрізнити ГСО та ССО. Рекомендації щодо лікування
ССО викладені в настановах, розроблених AAP, AAFP та Американською академією
отоларингології – хірургії голови та шиї.84,85
30
Таблиця 4. Рекомендації з початкового лікування неускладненого ГСОа
Вік
Оторея з ГСОа
Одно-
або Двобічний ГСОа Однобічний ГСОа
двобічний ГСОа з без отореї
без отореї
тяжкими
симптомамиb
Від 6
Антибіотикотерап
Антибіотикотерап
Антибіотикотера Антибіотикотерап
місяців
ія
ія
пія
ія або тактика
до 2
спостереження
років
2 роки
Антибіотикотерап
Антибіотикотерап
Антибіотикотера Антибіотикотерап
та
ія
ія
пія або тактика
ія або тактика
старше
спостереження
спостереженняc
a Стосується тільки дітей з точно встановленим, підтвердженим діагнозом ГСО (див. розділ
«Діагностика»);
b У дитини прояви інтоксикації, стійка отальгія тривалістю більше 48 годин, температура
≥39˚С (102,2˚F) протягом останніх 48 годин або сумнів щодо можливості контакту з
батьками/опікунами після візиту.
c Такий план початкового лікування дає можливість спільного із сім’єю дитини прийняття
рішення у випадках, коли допускається спостереження. Коли запропоновано спостереження,
повинен бути задіяний механізм забезпечення подальшого нагляду та початку прийому
антибіотиків, якщо стан дитини погіршується або не покращується через 48–72 години після
початку ГСО.
Коментар робочої групи: робоча група вважає, що ГСО у дітей віком до 6-ти
місяців є підставою для призначення антибіотиків у всіх випадках; при отореї (в т.ч. після
введення тимпаностомних шунтів) доцільно додаткове місцеве застосування вушних
крапель з антибіотиком без ототоскичних властивостей (наприклад, фторхінолонів).
Робоча група також вважає доцільним виділити у вигляді окремої таблиці критерії
диференційної тяжкості ГСО у дітей на основі критеріїв настанови Американської
академії педіатрії «The diagnosis and management of acute otitis media», 2013.
Критерії тяжкості ГСО у дітей
прояви інтоксикації, сильна оталгія, стійка оталгія
Тяжкий ГСО тривалістю більше 48 годин, температура ≥ 39 ºС протягом
Тяжкість
останніх 48 годин
перебігу
відсутні проявів інтоксикації, несильна оталгія тривалістю
Нетяжкий
менше 48 годин, температура до 39
ГСО
ºС протягом останніх 48
годин
Вік, тяжкість симптомів, оторея та латеральність
Rovers та співав.62 провели системний аналіз досліджент з ГСО, в яких: (1) застосовували
випадковий метод розподілу дітей, (2) включали діти з ГСО віком від 0 до 12 років, (3)
антибіотики порівнювали з плацебо або відсутністю лікування та (4) клінічним критерієм
вважалися біль або гарячка. Відповідних дослідників попросили надати початкові дані.
Первинним клінічним критерієм вважалися біль та/або гарячка (>38 °C) протягом 3-7 днів.
Також аналізувалися побічні ефекти антибіотиків. Прогностичними факторами на
початковому рівні були вік менше 2 років в порівнянні з віком більше 2 років, двобічний
ГСО в порівнянні з однобічним та наявність отореї в порівнянні з її відсутністю. Для оцінки
гетерогенності та аналізу даних застосовували статистичні методи.
31
З 10 досліджень, що відповідали критеріям, дослідники 6 досліджень30,75,86–89 надали запитані
початкові дані, а решти 4 – ні. Всього в 6 досліджень, за якими було отримано дані, було
включено 1642 пацієнти. Середній вік дітей склав 3–4 роки, 35% дітей були молодше 2 років.
Двобічний ГСО був у 34% дітей, а 42% дітей мали випинання БП. Оторею було виявлено у
21% дітей. Групу антибіотиків та контрольну групу порівнювали за всіма показниками.
Різниця показників (РП) для болю, гарячки або поєднання того і іншого між групою
антибіотиків і контрольною групою склала 13% (кількість хворих, яких необхідно
пролікувати (NNT=8). У дітей молодше 2 років РП склала 15% (NNT=7); у дітей старше 2
років РП склала 11% (NNT=10). Для однобічного ГСО РП була 6% (NNT=17); для двобічного
ГСО РП склала 20% (NNT=5). Коли хворих з однобічним ГСО розподілили на вікові групи,
серед дітей молодше 2 років РП склала 5% (NNT=20), а серед дітей старше 2 років РП була
7% (NNT=15). Для двобічного ГСО у дітей молодше 2 років РП була 25% (NNT=4); для
двобічного ГСО у дітей старше 2 років РП склала 12% (NNT=9). Для отореї РП була 36%
(NNT=3). В однієї дитини в контрольній групі розвився менінгіт, через погіршення стану
дитина отримувала антибіотики, починаючи з 2-го дня. Випадків мастоїдиту не виявлено.
В Кокранівському огляді Сандерс та ін. (Sanders та ін.)59 виділили 10 досліджень, що
відповідали наступним критеріям: (1) РКД, (2) порівняльне дослідження антибіотику проти
плацебо або антибіотику проти спостереження, (3) вік від 1 місяця до 15 років, (4)
зареєстрована тяжкість та тривалість болю, (5) зареєстровані небажані явища та (6)
зареєстровані серйозні ускладнення ГСО, рецидиви та проблеми із слухом. Дослідження
проаналізовали на предмет ризику відхилення та оцінки гетерогенності. Дослідження були ті
ж самі, що аналізувалися Rovers та співав.,62 але включали 4 додаткових дослідження,
первинні дані за якими не були доступні Роверу.60,61,90,91
За висновками авторів, застосування антибіотиків дозволило незначно зменшити кількість
дітей, які відчували біль, через 2–7 днів після діагностування. Автори також дійшли
висновку, що більшість випадків спонтанно перейшли в стадію ремісії без ускладнень
(NNT=16). Антибіотики були найбільш корисними для дітей молодше 2-х років з двобічним
ГСО та у дітей з отореєю.
Два нещодавніх дослідження включали тільки дітей молодше 3-х років32 або молодше 2-х
років.31 Обидва включали тільки осіб із підтвердженим діагнозом ГСО. В обох дослідженнях
визначенням клінічного успіху або невдачі було полегшення симптомів або покращення
зовнішнього вигляду БП.
Hoberman та співав.31 провели рандомізоване, подвійне сліпе, плацебо-контрольоване
дослідження ефективності антимікробної терапії при ГСО. Критеріями ГСО були гострі
симптоми з показником не менше 3 за шкалою симптомів ГСО (AOM-SOS);33,92 секрет у
середньому вусі, помірне або виражене випинання БП, або незначне випинання, що
супроводжується отальгією або вираженою гіперемією БП. В якості активного лікування
було обрано амоксицилін-клавуланат у високих дозах (90 мг/кг/день), оскільки серед
оральних препаратів в нього найширший спектр активності проти організмів, що викликають
ГСО. В дослідження було включено 291 пацієнтів віком від 6 до 23 місяців: 144 в групі
антибіотиків і 147 в групі плацебо. Визначенням первинного результату були час до регресії
симптомів та суб’єктивна вираженість симптомів із часом. Серед дітей, що отримували
амоксицилін-клавуланат, первинна регресія симптомів (тобто, перший зафіксований
показник AOM-SOS 0 або 1) була зареєстрована у 35% на 2-й день, у 61% – на 4-й день і у
80% – на 7-й день.
Серед дітей, що отримували плацебо, показник AOM-SOS 0 або 1 був зареєстрований у 28%
на 2-й день, у 54% – на 4-й день і у 74% – на 7-й день (при загальному порівнянні Р=0,14).
Для стійкої регресії симптомів (тобто, час до другого з 2 послідовно зафіксованих показників
AOM-SOS 0 або 1) відповідні значення складали у 20% на 2-й день, у 41% – на 4-й день і у
67% – на 7-й день при застосуванні амоксицилін-клавуланату, у порівнянні з 14%, 36% і 53%
при застосуванні плацебо (при загальному порівнянні Р=0,04). Суб’єктивна переносимість
32
симптомів (тобто, середні показники AOM-SOS) протягом перших 7 днів була нижчою у
дітей, які приймали амоксицилін-клавуланат, ніж у тих, що отримували плацебо (Р=0,02).
Клінічна невдача під час візиту на 4-5 день або раніше визначалася як «відсутність значного
полегшення симптомів, погіршення ознак при отоскопічному обстеженні, або поєднання
того й іншого», а клінічна невдача під час візиту на 10-12 день визначалася як «недосягнення
повної або майже повної регресії симптомів та отоскопічних ознак, незалежно від стійкості
або регресії ексудативного середнього отиту». Клінічна невдача на 4-й або 5-й день була
зареєстрована у 4% пацієнтів в групі антибіотиків проти 23% в групі плацебо (Р < 0,001), а на
10-12 день у 16% пацієнтів в групі антибіотиків проти 51% в групі плацебо (NNT=2,9;
Р<0,001). У порівнянні результату при однобічному проти двобічного ГСО показники
клінічної невдачі на 10-12 день у дітей з однобічним ГСО становили 9% у тих, хто приймав
амоксицилін-клавуланат проти 41% у тих, кому давали плацебо (РП 32%; NNT=3) та 23%
проти 60% (РП 37%; NNT=3) у хворих з двобічним ГСО. Найпоширенішими небажаними
явищами були діарея (25% проти 15% в групі лікування і групі плацебо, відповідно; Р=0,05)
та пелюшковий дерматит (51% проти 35% в терапевтичній групі та групі плацебо,
відповідно; Р=0,008). У одного хворого, що приймав плацебо, розвився мастоїдит. Згідно
цим результатам, антибіотикотерапія ГСО була більш корисною, ніж у попередніх
дослідженнях, де застосовувалися менш чіткі діагностичні критерії.
Tahtinen та співав.32 провели рандомізоване, подвійне сліпе, плацебо-контрольоване
дослідження всіх пацієнтів, що почали лікування амоксицилін-клавуланатом (40 мг/кг/день)
проти плацебо. Досліджували 319 пацієнтів віком від 6 до 35 місяців: 161 в групі
антибіотиків і 158 в групі плацебо. Критеріями визначення ГСО були наявність секрету в
середньому вусі, пожовтіння або виражена гіперемія на фоні випинання БП, гострі
симптоми, такі як біль, гарячка або респіраторні симптоми. Комплаєнтність визначалася
шляхом вивчення щоденника пацієнта та підрахуванням кількості капсул, що залишилися по
закінченні дослідження. Первинним результатом вважався час до невдачі лікування, яка
визначалася комплексом 6 незалежних компонентів: відсутність покращення загального
стану на 3-й день, погіршення стану дитини в будь-який час, відсутність покращення
отоскопічних ознак на 8-й день, перфорація БП, розвиток серйозної інфекції (напр.,
пневмонія, мастоїдит) та будь-яка інша причина для припинення дослідження
препарату/плацебо.
Групи порівнювали за багатьма параметрами. У групі лікування 135 пацієнтів із 161 (84%)
були молодше 24 місяців, в групі плацебо 124 із 158 пацієнтів (78%) були молодше 24
місяців. Терапевтична невдача була зафіксована у 18,6% пацієнтів в терапевтичній групі та
44,9% – в групі плацебо (NNT=3,8, Р=0,001). Резервна терапія знадобилася 6,8% пацієнтів в
терапевтичній групі та 33,5% в групі плацебо (Р<0,001). Контралатеральний ГСО розвився у
8,2% та 18,6% в терапевтичній групі та групі плацебо, відповідно (Р=0,07). Не виявлено
значної різниці у використанні знеболювальних або жарознижувальних препаратів, які
застосовували у 84,2% пацієнтів в групі амоксицилін-клавуланату та 85,9% в групі плацебо.
Батьки дітей, що приймали плацебо, пропустили більше днів своєї роботи (Р=0,005).
Показники клінічної невдачі у дітей з однобічним ГСО склали 17,2% серед тих, кого
лікували амоксицилін-клавуланатом проти 42,7% серед тих, кому давали плацебо; для
двобічного ГСО показники клінічної невдачі склали 21,7% серед тих, хто приймав
амоксицилін-клавуланат проти 46,3% в групі плацебо. Зареєстровані показники клінічної
невдачі на 8-й день у дітей з однобічним ГСО становили 17,2% в групі амоксицилін-
клавуланату проти 42,7% в групі плацебо та 21,7% проти 46,3% серед хворих з двобічним
ГСО.
Небажані явища, головним чином діарея та/або висипання, були зареєстровані у 52,8% в
терапевтичній групі та 36,1% в групі плацебо (Р=0,003). Оцінка загального стану, надана
батьками та підтверджена отоскопічним обстеженням БП, довела перевагу антибіотиків над
плацебо наприкінці терапевтичного візиту (Р<0,001). У двох пацієнтів, що приймали
33
плацебо, розвилася серйозна інфекція; в одного пацієнта розвилася пневмококова
бактеріємія, а в іншого приєдналася рентгенографічно підтверджена пневмонія.
З більшості досліджень було виключено дітей з тяжким ступенем захворювання, і з усіх було
виключено хворих на інші бактеріальні захворювання (пневмонія, мастоїдит, менінгіт,
стрептококовий фарингіт). В своєму дослідженні Kaleida та співав.91 порівнювали
міринготомію окремо та міринготомію, поєднану з антибіотиками. Тяжкий ступінь ГСО
визначали гарячкою >39°C або наявністю тяжкої оталгії. Пацієнти з тяжким ступенем ГСО в
групі, де було проведено тільки міринготомію (без початкових антибіотиків), мали суттєво
гірші результати.
Початкова антибіотикотерапія
Актуальність теми антибіотикотерапії у дітей з ГСО обумовлена високою поширеністю
бактерій в секреті середнього вуха.93 Бактеріальні та вірусні культури середнього вуха,
отримані шляхом тимпаноцентезу у дітей з ГСО, виявили наявність бактерій у 55% випадків,
а наявність бактерій і вірусів у 15%. Позитивна дія антибіотиків при лікуванні ГСО вперше
була продемонстрована в 1968 році,94 в подальшому були проведені додаткові РКД та
метааналіз,95 які показали, що абсолютні показники клінічного покращення збільшилися на
14%. Систематичні огляди літератури, опублікованої до 2011 року,21,59,62 продемонстрували
збільшення клінічного покращення при застосуванні початкової антибіотикотерапії на 6–
12%.
РКД із застосуванням чітких критеріїв для діагностування ГСО у маленьких дітей31,32
показали різницю в клінічному покращенні 26–35% на користь початкової
антибіотикотерапії у порівнянні із плацебо. Більша користь негайної антибіотикотерапії була
зафіксована при двобічному ГСО62,96 або ГСО, що супроводжується отореєю.62 Більшість
РКД30,75,77,88,89 показала, що антибіотикотерапія зменшила тривалість болю, застосування
анальгетиків, кількість пропущених днів у школі та пропущених батьками робочих днів.
Дітям з ГСО молодше 2 років може потребуватися більше часу для клінічного покращення,
ніж старшим дітям,57 і хоча вони з великою вірогідністю отримують користь від
антибіотиків,31,32 ГСО у багатьох дітей регресує і без антибіотикотерапії.62 Клінічно значуща
користь негайної антибіотикотерапії спостерігається при двобічному ГСО,62,96 наявності
інфекції Streptococcus pneumonia або ГСО, що супроводжується ото реєю.62
Первинне спостереження при ГСО
В систематичних оглядах досліджень, що порівнюють антибіотикотерапію при ГСО з
плацебо, стійким результатом був загальний сприятливий перебіг хвороби в контрольній
групі (NNT=8–16).12,59,62,95 Проте, РКД в цих оглядах застосовували різні діагностичні
критерії, які припускали включення деяких дітей з ССО, вірусними інфекціями верхніх
дихальних шляхів або мірингітом, таким чином обмежуючи можливість застосувати
отримані дані для дітей з підтвердженим діагнозом ГСО. В пізніших дослідженнях ГСО31,32
із застосуванням чітких діагностичних критеріїв приблизно в половини маленьких дітей
(молодше 2–3 років) був зареєстрований клінічний успіх при застосуванні плацебо, але ефект
антибіотикотерапії був значно більшим, ніж у дослідженнях без точного діагностування
(NNT=3–4).
При виборі спостереження в якості початкової терапії ГСО у певним чином відібраних дітей
гнійні ускладнення не виникають за умови забезпечення відповідного нагляду та
застосування резервного антибіотику при стійкості симптомів або їх погіршенні.17 І навпаки,
при відмові від застосування антибіотиків у всіх дітей з ГСО, незалежно від клінічного
перебігу хвороби, може виникнути ризик гнійних ускладнень, що спостерігали в часи, коли
антибіотики не застосовували. На рівні популяції антибіотики удвічі знижують ризик
мастоїдиту після ГСО, але висока NNT (приблизно 4800 пацієнтів) для запобігання 1 випадку
мастоїдиту виключає стратегію універсальної антибіотикотерапії як засобу профілактики
мастоїдиту.83
34
Сприятливий перебіг ГСО ускладнює демонстрацію істотної різниці в ефективності між
антибіотиком і плацебо у випадках, коли успішний результат обумовлений полегшенням
існуючих симптомів або покращенням ознак. Навпаки, коли для визнання позитивного
результату вимагається також покращення отоскопічних ознак (регресія випинання БП,
інтенсивної гіперемії, або і того й іншого),31,32 NNT становить 3-4, у порівнянні з 8-16 тільки
при полегшенні симптомів у попередніх дослідженнях, які застосовували менш точні
діагностичні критерії. Проте, ССО може утримуватися тижнями або місяцями після епізоду
ГСО і не є критерієм отоскопічної невдачі лікування.
Національні настанови з первинної тактики спостереження при ГСО у деяких дітей були
вперше розроблені в Нідерландах,97 а потім послідовно у Швеції,98 Шотландії,99 США,1
Сполученому Королівстві100 та Італії.101 Всі вони включали тактику спостереження як
варіант початкового лікування при певних обставинах. Численні дослідження показали, що
лише близько третини дітей із первинним спостереженням отримували резервний антибіотик
при персистуючому або ускладненому ГСО.30,32,76,81,89,102 Це дає підстави припустити, що у
дітей, які відповідають зазначеним критеріям, застосування антибіотиків потенційно можна
знизити на 65%. Маючи на увазі високу частоту ГСО, таке зниження могло б значно сприяти
запобіганню небажаних явищ, пов’язаних з антибіотиками.
McCormick та співав.30 провели дослідження за участю 233 пацієнтів, яким методом
випадкового розподілу було призначено або негайну антибіотикотерапію (амоксицилін,
90 мг/кг/день) або динамічне спостереження. Критеріями включення були симптоми
запалення середнього вуха, отоскопічний доказ ГСО, неускладнений ГСО на основі 3-
бальної шкали симптомів середнього отиту (СО-3) та зовнішній вигляд БП на основі 8-
бальної шкали отоскопії (OS-8). Первинними результатами вважалися задоволення батьків
лікуванням ГСО, регресія симптомів ГСО після початкового лікування, невдача лікування
ГСО та його рецидиви і носоглоткове носійство резистентних до антибіотиків штамів S
pneumoniae після лікування. Результати дослідження були неточними через включення
пацієнтів, що приймали антибіотики в останні 30 днів.
В групі динамічного спостереження 66% дітей дійшли до кінця дослідження без прийому
антибіотиків. Різниці в показниках батьківського задоволення на 12-й день не було.
Симптоми за 5-бальною шкалою ETG-5 оцінювались в дні з 0 по 10-й за допомогою
щоденника батьків. В пацієнтів, що отримували негайну антибіотикотерапію, симптоми
регресували швидше, ніж у тих, що були під динамічним спостереженням (Р=0,004). У дітей
молодше 2 років різниця була більшою (Р=0,008). Показники отоскопії та тимпанограми
були також нижчими в групі антибіотиків на противагу групі динамічного спостереження
(Р=0,02 для отоскопії, Р=0,004 для тимпанограми). При об’єднанні всіх вікових груп
показники невдачі та рецидиву на 12-й день були нижчими в групі антибіотиків (5%), ніж у
групі динамічного спостереження (21%). На 30-й день не було різниці в показниках невдачі
або рецидиву в групах антибіотиків та динамічного спостереження (23% і 24%, відповідно).
Зв’язок між клінічним результатом та експериментальною групою не мав суттєвих
відмінностей у різних вікових групах. Негайна антибіотикотерапія сприяла ліквідації
носійства S pneumoniae у більшості дітей, але штами S pneumoniae у дітей в групі
антибіотиків на 12-й день мали більшу вірогідність мультирезистентності, ніж у дітей з
групи динамічного спостереження.
Рішення не призначати початкову антибіотикотерапію та проводити спостереження повинно
бути спільним рішенням лікаря-клініциста та батьків. В таких випадках повинен бути
задіяний механізм уважного подальшого нагляду і початку прийому антибіотиків, якщо
симптоми погіршуються або немає видимого покращення через 48–72 години.
Первинне спостереження при ГСО повинно бути частиною ширшої стратегії лікування, що
включає застосування анальгетиків, отримання інформації від батьків і призначення
резервного антибіотику. Освітня робота серед батьків повинна включати пояснення про те,
що більшість епізодів ГСО мають тенденцію до самоодужання, особливо у дітей віком 2-х
35
років і старше, важливість усунення болю на ранніх етапах та можливі побічні ефекти
антибіотиків. Такий підхід може суттєво зменшити призначення резервних антибіотиків.103
Найважливіший компонент будь-якої стратегії при лікуванні ГСО, в т.ч. первинного
спостереження, це можливість приймання резервного антибіотику у випадку необхідності.
Це часто робиться шляхом застосування так званої «страхувальної сітки», коли призначення
дійсне лише протягом 5-ти днів (SNAP – «safety net antibiotic prescription»), або тактики
очікування під час призначення препарату (WASP – «wait and see prescription»),76,102 при
якому батькам/опікунам під час клінічної зустрічі призначається антибіотик для дитини, але
дається інструкція виконувати призначення, тільки якщо в дитини не буде покращення
протягом 2–3 днів, або якщо в будь-який час симптоми погіршаться. Альтернативний підхід
– не давати письмового призначення, але наказати батькам/опікунам зателефонувати або
прийти, якщо в дитини не буде покращення протягом 2–3 днів або симптоми погіршаться.
В одне з перших великих досліджень спостереження із застосуванням SNAP, Siegel та
співав.102 включили 194 пацієнта з діагнозом ГСО згідно протоколу, з яких 175 дійшли до
кінця дослідження. Пацієнтам, що відповідають критеріям, давали SNAP з інструкцією
виконувати призначення тільки у випадку, якщо симптоми погіршуються або немає
покращення через 48 годин. SNAP був дійсним протягом 5-ти днів. При необхідності
рекомендувалося приймати знеболювальні препарати. Через 5–10 днів після діагностування
проводилось телефонне опитування.
Сто двадцять із 175 сімей не виконали призначення. У випадках, коли призначення було
виконане, причини були наступними (допускалося більше 1 причини на пацієнта): тривалий
біль – 23%; тривала гарячка – 11%; порушення сну – 6%; пропуск батьками днів на роботі –
3%, пропуск днів по догляду за дитиною – 3%; немає видимих причин – 5%. В одного 16-
місячного хлопчика період спостереження завершився успішно, але через 6 тижнів розвився
ГСО другого вуха, дитину лікували антибіотиками, після чого розвився завушний целюліт.
В подібному дослідженні щодо призначення WASP у відділенні інтенсивної терапії, Spiro та
співав.76 методом випадкового розподілу дали 283 пацієнтам або WASP, або стандартне
призначення. Лікарі-клініцисти пройшли навчання щодо діагностичних критеріїв та варіантів
початкового лікування ГСО згідно настанови ААР 2004 року; однак діагноз ставився на
розсуд лікаря. Пацієнтів виключали з дослідження, якщо вони не відповідали вимогам щодо
спостереження у відповідності до рекомендацій 2004 року. Первинний результат базувався
на тому, чи було виконано призначення протягом 3 днів після діагностування. Призначення
не були виконані у 62% WASP і 13% стандартних призначень (Р<0,001). Причинами для
виконання призначення в групі WASP були гарячка (60%), вушний біль (34%) або капризна
поведінка (6%). Повідомлень про серйозні небажані явища не було.
Стратегія спостереження дітей з ГСО, стан яких, скоріше за все, покращиться сам собою, без
початкової антибіотикотерапії, зменшує ризик поширених побічних ефектів антибіотиків,
таких як діарея та пелюшковий дерматит. В 2 дослідженнях доведено, що антибітикотерапія
значно підвищує абсолютні показники діареї (на 10–20%), а пелюшкових висипань або
дерматиту на 6–16%.31,32 Обмеження застосування антибіотиків може також зменшити
поширеність резистентних бактерій. Мультирезистентний штам
S. pneumoniae залишається
питанням серйозної стурбованості при лікуванні ГСО, незважаючи на загальну імунізацію
дітей в США семивалентною антипневмококовою кон’югованою вакциною.104,105 І навпаки, в
країнах з низьким застосуванням антибіотиків при лікуванні ГСО поширеність резистентних
носоглоткових патогенів у дітей нижча.106
«MANAGEMENT OF ACUTE OTITIS MEDIA IN CHILDREN SIX MONTHS OF AGE AND
OLDER», Canadian Paediatric Society Infectious Diseases and Immunization Committee
Paediatr Child Health 2016.
ВЕДЕННЯ ГСО НА ОСНОВІ ВИЗНАНИХ КРИТЕРІЇВ
Всіх дітей з перфорацією БП, які мають симптоми ГСО слід негайно почати лікувати
системними протимікробними засобами і обстежити на асоційовані ускладнення.
36
Щоб допомогти визначити, яким дітям без перфорації БП, найбільше принесе користь
антимікробна терапія ГСО, два великих плацебо-контрольованих дослідження за участю
дітей старше 6-місячного віку були проведені в Європі і Північній Америці. Критерії для
ГСО були гострі симптоми гарячки, оталгія або респіраторні симптоми у поєднанні з
жорсткими об’єктивними критеріями для середнього вуха (випіт середнього вуха або рівні
«повітря–рідини» за БП, а також помірним або вираженим випинання БП, що
супроводжуються вираженою еритемою або крововиливом, або пожовтінням БП). [21] [22]
Використовуючи ці критерії, були значно більше невдач в групі плацебо (35%) порівнянно з
групою лікування (19%), що сильно вказує на те, що у дітей, для яких діагноз проводиться з
використанням строгих критеріїв, лікування протимікробними засобами, імовірно, буде
корисним. При цьому, число тих, яких потрібно пролікувати, щоб отримати користь для
однієї дитини з ГСО, становило близько чотирьох. При порівнянні результатів двох
досліджень для дітей від 6-ти місяців до 2-х років з жорсткими критеріями, частота невдач з
плацебо становила від 40% до 59%, але з протимікробними препаратами – тільки 14% до
25%, що додатково вказує на переваги антимікробної терапії в цих конкретних клінічних
ситуаціях. [36]
Проте, рішення щодо того, яких дітей можна безпечно лікувати без емпіричної
антибактеріальної терапії повинне деякою мірою залежити від клінічного судження, але й
повинно включати об’єктивні критерії, такі як тривалість і тяжкість захворювання. Діти, які
мають легке або помірне випинання БП, незначну тяжкість захворювання, позитивно
реагують на жарознижуючі препарати, мають невисоке підвищення температури (<39°C) і
м’яку оталгію можнуть знаходитися під спостереженням протягом певного часу (від 24 год
до 48 год). Можливість корекції лікування в процесі спостереження за пацієнтом при зміні
його стану, або «відкладення» початку призначення протимікробних засобів можуть бути
прийнятливими підходами, залежно від клінічних та соціальних умов. Діти з ГСО
(підтверджений випинаючою БП), які мають високу температуру (≥39°C) і помірний –
тяжкий загального стану, або діти, які мають сильну оталгію або були дуже хворі протягом
48 год, слід лікувати за допомогою антимікробних препаратів (Рисунок 1).
У всіх випадках, ті, хто опікується хворим повинні бути поінформовані про це, і бути
уважними щодо будь-яких змін або погіршення симптомів, а також повинні мати вільний
доступ до медичного обслуговування. Якщо симптоми погіршуються або не покращилися
протягом 24–48 год, слід призначати протимікробні препарати. Пояснення, що стосуються
плану ведення слід обговорити з тими, хто доглядає за дитиною, щоб в прийнятті рішень всі
брали участь. Вкрай важливо, щоб їм надали відповідні рекомендації щодо застосування
анальгетиків.
ВЕДЕННЯ У ВИПАДКУ ДІАГНОСТИЧНОЇ НЕВИЗНАЧЕНОСТІ
Насправді, лікар часто стикається з дилемою з дітьми, у яких БП не може бути належним
чином оцінена. З багатьох причин (наприклад, пацієнт не йде на контакт, невеликий вушний
канал, недосвідчений спостерігач або неналежне обладнання) лікарі можуть не бути в змозі
остаточно визначити, чи є випинання БП. У цих ситуаціях, диференційний діагноз може
включати в себе вірусні захворювання верхніх дихальних шляхів з асоційованим середнім
отитом з випотом, системні вірусні захворювання або ГСО, який може пройти без
спеціального лікування. Застосування протимікробних препаратів в таких ситуаціях може
бути непотрібним.
Якщо загальний стан дитини мало порушений, вітсутня оталгія, аппетит збережений, має
температуру <39°С протягом <24 год і поруч надійні люди, які доглядають за дитингою, тоді,
розумно спостерігати, і щоб дитина і ті, хто доглядає за дитиною, повернулися на
дообстеження наступного дня. У центрі уваги повторної консультації динаміка стану БП або
динаміка інших симптомів. Як і в сценарії «пильного очікування» для підтвердженого ГСО,
роз’яснення щодо плану ведення слід обговорити з тими, хто доглядає за дитиною, для
37
спільно узгодженого ведення дитини. Знову ж таки, дуже важливо забезпечити відповідні
рекомендації щодо анальгетиків.
Старше 6-ти місяців; здоровий в іншому плані
Гострий початок захворювання
З або без гарячки; має або не має маніфестацію інших ознак дисфункції середнього
вуха (наприклад, блювання) або біль, в залежності від віку та вербальних навичок
Підозра на ГСО
Перфорована БП з
Випіт в середньому вусі
Відсутній випіт в середньому
гнійними виділеннями
ТА випинання БП
вусі;
АБО випіт в середньому
вусі без випинання БП або
еритема БП легкого ступеня
Антибіотикотерапія
Середній або тяжкий ступінь
10 днів
Наприклад, дратівливість,
поганий сон, незначна відповідь
на антипіретики, тяжка оталгія;
АБО ≥39˚C при відсутності
антипіретиків;
Легкий ступінь
АБО симтоматика триває >48
Жвавий, йде на контакт,
год
Розгляньте вірусну етіологію
відсутній озноб,
(наприклад, респіраторно-
відповідає на
синцитіальний вірус, грип
антипіретики, незначна
тощо) або іншу інфекцію
оталгія, спроможний
Антибіотикотерапія:
Повторно огляньте через 24–48
спати;
6 міс. – 2 роки – 10 днів;
год, якщо немає клінічного
<39˚C при відсутності
старше 2-х років – 5 днів.
покращення або раніше, якщо є
антипіретиків;
клінічне погіршання, з оцінкою
симтоматика триває <48
наявності випоту та ознак
год
запалення середнього вуха
(наприклад, випинання БП)
Після дискусії з тими, хто доглядає за дитиною, огляд
через 24–48 год з метою призначення подальшого
лікування. Рекомендувати анальгетики.
Якщо клінічний стан не покращується або
погіршується, антибіотикотерапія: 6 міс. – 2 роки – 10
днів; старше 2-х років – 5 днів
Рисунок 1. Блок-схема лікування дітей з підозрюваним або підтвердженим ГСО.
ВАЖЛИВІСТЬ ЯК ВИБОРУ ТАК І ДОЗи ПРОТИМІКРОБНИХ ЗАСОБІВ
У той час як існує менше даних про антимікробну чутливістьі бактерій, що викликають ГСО,
чутливість
S. pneumoniae до пеніциліну, яка викликає інвазивну хворобу, становить >90%
більшості регіонів Канади [37] – [39]. Оскільки
S. pneumoniae є переважаючим збудником в
ГСО і оскільки вона охоплює також стрептококи групи А, емпірично амоксицилін
залишається препаратом першого вибору.
M. catarrhalis і деякі штами
H. influenzae, більш
імовірно, будуть амоксицилін-стійкі (тобто, продукують бета-лактамази), але вони менш
поширені патогени, і ГСО, викликані однією з цих бактерій, швидше за все, прогностично
закінчиться самостійно.
Амоксицилін чудово проникаєдо середнього вуха (може бути ефективним, незважаючи на
резистентність
in vitro), недорогий, добре переноситься і має відносно вузький
антимікробний спектр. Він має короткий період напіврозпаду, приблизно 1 годину. В
адекватній пероральній дозі амоксицилін частіше, ніж інші оральні антибактеріальні
препарати, буде ефективним проти пеніцилін-чутливих і деяких з стійких до пеніциліну
S. pneumoniae, бета-лактам-негативних
H. influenzae та стрептококів групи А. Для клінічного
лікування ГСО, рівні концентрації амоксициліну в середньому вусі мають підтримуватися
38
протягом не менше 12-ти годин на добу. Введення від 45 мг/кг/добу до 60 мг/кг/добу
амоксициліну, розподілених на три прийоми, досягне адекватної концентрації в середньому
вусі, в той час як режим дозування два рази на день вимагає більш високої сумарної добової
дози 75 мг/кг/добу до 90 мг/кг/добу для підтримки необхідної локальної добової
концентрації препарату (таблиця 1). [40]
Є певні клінічні ситуації, в яких інші протимікробні препарати слід розглядати в якості
першої лінії. В умовах ГСО з гнійним кон’юнктивітом (отит-кон’юнктивіт синдром),
H. influenzae та
M. catarrhalis є частими патогенами і, отже, найбільш прийнятним є
лікування комбінацією амоксициліном з інгібітором бета-лактамаз (наприклад, амоксицилін-
клавуланат) або другою генерацією цефалоспоринів (наприклад, цефуроксим-аксетил). [41]
При недостатній швидкості позитивної динаміки хвороби необхідна бактеріальна
діагностика причин гнійного кон’юнктивіту. Також може бути доцільно використовування
амоксицилін-клавуланат, якщо дитина недавно (протягом останніх 30-ти днів) лікувалась
амоксициліном або у випадку рецидиву інфекції або у випадку нечутливості до
амоксициліну.
Якщо в анамнезі у дитини гіперчутливість до амоксициліну або пеніциліну, прийнятним є
використання цефалоспоринів другого покоління (цефпрозил або цефуроксим-аксетил) або
цефалоспоринів третього покоління, за виключенням попередніх випадків побічних реакцій
загрозливих для життя (ангіоневротичний набряк, бронхоспазм або гіпотензія) [42] . В якості
альтернативи використовуються макроліди/азаліди (кларитроміцин або азитроміцин) або
кліндаміцин. Проте, ці антибіотики, порівняно з бета-лактамами (наприклад, пеніциліни або
цефалоспорини), як правило, мають гірші антибактеріальні власивості, особливо до
S. pneumoniae та
H. influenzae. Лише в окремих випадках призначаються інші препарати,
наприклад доксициклін у дітей ≥8 років або хінолони; Проте, такі альтернативні призначення
слід робити в кооперації з лікарем-інфекціоністом.
Симптоми повинні покращитися протягом 24-х годин і зникнути протягом 2–3 днів, від
початку отримання протимікробних препаратів. Якщо симптоми зберігаються або
погіршуються, пацієнт повинен бути проконсультований повторно з метою оцінки
прогресування основного захворювання ГСО, або його ускладнень. Якщо ГСО зберігається,
незважаючи на призначення відповідних доз амоксицилін , це може вказувати на
H. Influenzae та
M. Catarrhalis, як причину ГМСО. У цих умовах, лікування повинно бути
змінено на амоксицилін-клавуланат, залишаючи за собою внутрішньовеннbq або
внутрішньом’язовbq цефтриаксон для випадків, коли пероральні препарати з різних причин
протипоказані, або амоксицилін-клавуланат не дав очікуваного одужання (Таблиця 1). В
таких незвичайних ситуаціях цефтриаксон слід вводити протягом трьох днів, оскільки період
напіврозпаду препарату більше (приблизно 12–24 год), з можливим проведенням відбору
проб рідини середнього вуха.
Випіт середнього вуха може зберігатися протягом декількох місяців, незважаючи на
вітсутність клінічних проявів і бактеріологічних змін. Присутність випоту середнього вуха
не вимагає зміни протимікробних препаратів.
Коментар робочої групи: станом на 16 вересня 2016 року препарати цефпрозилу
(АТС-код: J01DC10) в Україні не зареєстровані.
НЕОБХІДНА ТРИВАЛІСТЬ АНТИБАКТЕРІАЛЬНОЇ ТЕРАПІЇ ГСО
П’ять днів антибактеріальної терапії оральним амоксициліном показало ефективність 10-
денного курсу терапії у більшості дітей ≥2 років з неускладненою формою хвороби [43] –
[45]. Десятиденний курс пероральної антибактеріальної терапії є адекватним для дітей віком
до 2-х років, для дітей з рецидивуючим ГСО або середнім отитом, пов’язаним з
перфоровацією БП, а також для випадків, коли основна терапія не дала бажаних результатів.
Рекомендації
39
Діагностичними ознаками ГСО є гострий початок симптомів, таких як оталгія (або
неспецифічні симптоми у дітей молодшого віку), ознаки випоту в середнє вухо,
асоційовані із запаленням середнього вуха (тобто БП, яка випинає,гіперемована або
геморагічна, пожовтівша або помутнівша) або розрив БП.
Для практично здорових дітей 6-ти місячного віку, які мають незначні прояви хвороби
з відповідними діагностованими критеріями ГСО, або дітей, які не повністю
підпадають під критерії ГСО, рекомендуєтьтся динамічне спостереження протягом
48-ми годин, якщо подальше лікування може бути гарантоване. Повинна бути надана
консультація щодо анальгетиків. Рекомендується:
o повторна оцінка дитини в межах 24–48 годин для документування клінічного
перебігу; АБО
o повторне звернення тих, хто доглядає за дитиною, якщо стан дитини не
покращується або погіршується впродовж 48-ми год; АБО
o призначення антимікробних препаратів, якщо стан дитини не покращується.
Дітей з випинаючою БП; тих, які мають гарячку (більше 39˚С); мають загальний стан
легкого – середнього ступеня тяжкості; дітей зі значною оталгією або тих, хто тяжко
хворий протягом 48 год, слід лікувати протимікробними препаратами.
Якщо прийнято рішення лікувати протимікробними препаратами, амоксицилін
розділений на два прийоми в дозі від 75 мг/кг/добу до 90 мг/кг/добу або амоксицилін
розділений на три прийоми в дозі від 45 мг/кг/добу до 60 мг/кг/добу, є першим
вибором для лікування ГСО.
П'ятиденний курс відповідно дозованого антимікробного препарату рекомендується для
більшості дітей 2-х років з неускладненим ГСО, 10-денний курс залишається для дітей
молодшого віку (від 6-ти до 23-х місяців) і випадків з перфорацією БП або рецидивуючого
ГСО.
Таблиця 1. Антимікробні засоби для ГСО
Лікування першої лінії (у разі відсутності алергії на пеніцилін):
• Амоксицилін – 75 мг/кг/добу–90 мг/кг/добу розподілений на два прийоми у вигляді капсул
або суспензій; АБО
• Амоксицилін – 45 мг/кг/добу –60 мг/кг/добу розподілений на два прийоми у вигляді капсул
або суспензій
Лікування першої лінії у разі алергії на пеніцилін (не життєво загрозлива реакція):
• Цефуроксим-аксетил – 30 мг/кг/добу розподілений на 2–3 прийоми у вигляді таблеток або
суспензії
• Цефтріаксон – 50 мг/кг внутрішньом’язово (або внутрішньовенно) щодня впродовж 3-х
днів
Якщо початкова терапія не допомагає (немає симптоматичного покращення після двох
– трьох днів лікування):
• Амоксицилін-клавуланат
У Канаді, переважно застосовують суспензію із співвідношенням 7: 1* оскільки вона має
найбільше амоксициліну в поєднанні з найменшою кількістю клавуланата. Кожні 5 мл
суспензії містять 400 мг амоксициліну і 57 мг клавуланату. Таким чином пацієнт, отримавши
60 мг/кг/добу препарату, отримає приблизно 8,5 мг/кг/добу клавуланата.
Доза клавуланата не перевищує 10 мг/кг/добу, оскільки вона пов’язана із високим ризиком
діареї.
• Для дитини з масою тіла ≤35 кг, 45 мг/кг/добу–60 мг/кг/добу розподілену на три прийоми
40
впродовж 10-ти днів. 400 мг/5мл суспензії із співвідношенням 7:1.
• Для дитини з масою тіла >35 кг, 500 мг перорально (таблетки) тричі на день впродовж 10-
днів.
Якщо пацієнт не переносить оральні антимікробні засоби або якщо лікування з амоксицилін-
клавуланатом зазнає невдачі, може бути розглянутий курс цефтриаксона – 50 мг/кг/добу
внутрішньом'язово (або внутрішньовенно) раз на добу впродовж 3-х днів.
Можна розглядати один прийом в день протягом трьох днів. В якості альтернативи може
бути розглянуте направлення до отоларинголога для тимпаноцентезу з метою визначення
етіологічного збудника і подальшої терапії.
*Препарат амоксициліну-клавуланат у співвідношенні 14:1 недоступний в Канаді
«KOREAN CLINICAL PRACTICE GUIDELINES: OTITIS MEDIA IN CHILDREN», 2016
Перша лінія антибіотикотерапії (Таблиця 4)
Ми рекомендуємо високі дози амоксициліну (80–90 мг/кг/добу) в якості антибіотика першої
лінії (рівень рекомендації: А). Проте, якщо пацієнт старше 24-х місяців, в анамнезі відсутнє
недавнє застосування антибіотиків, і не перебував в дитячому закладі, рекомендується
стандартна доза амоксициліну (40–50 мг/кг/добу). Для тяжкого ГСО, високі дози
амоксициліну/клавуланату (14:1) (80–90/6,4 мг/кг/добу) рекомендується в якості антибіотика
першої лінії, беручи до уваги можливість присутності бета-лактамазопродукуючої
H. influenzae,
M. catarrhalis, і стійких до пеніциліну пневмококів (11) (рівень рекомендації:
А).
У якості першої лінії антибіотикотерапії, високі дози орального амоксициліну (80–
90 мг/кг/день)
і
оральний
амоксицилін/клавуланат
(співвілношення
14:1)
80–
90/6,4 мг/кг/добу для тяжких випадків рекомендується настановою AAP 2004 року і інших
великомасштабних РКД (11, 14, 31). Проте, амоксицилін/клавуланат в співвідношенні 14:1 не
доступний в Кореї, тому амоксицилін може бути доданий до доступного
амоксицилін/клавуланат, щоб збільшити дозу амоксициліну до 80–90 мг/кг. Наприклад, в тих
випадках, коли використовується амоксицилін/клавуланат у співвідношенні 7:1, можна
ввести амоксицилін/клавуланат 40–50/6,4 мг/кг/добу плюс амоксицилін 40 мг/кг/добу. У
випадках з амоксициліном/клавуланатом у співвідношенні 4:1, слід призначити
амоксицилін/клавуланат 23/5,75 мг/кг/добу плюс амоксицилін 57 мг/кг/добу. При
призначенні амоксицилін/клавуланата, доза клавуланата не повинна перевищувати
10 мг/кг/день, оскільки при більш високих дозах може збільшуватися частота діареї (32, 33).
Показання до введення з самого початку терапії виключно антибіотиків без періоду
спостереження були згадані вище (Таблиця 3). Альтернативні препарати рекомендуються
для дітей, у яких в анамнезі були реакції гіперчутливості І-го типу на пеніциліни (наприклад,
кропив’янка, анафілаксія), в тому числі на макроліди. При реакціях гіперчутливості не I-го
типу, рекомендуються цефалоспорини як антибіотики першого ряду (11). Стандартний строк
введення антибіотиків становить 10 днів для випадків середнього і тяжкого ступеня; 5–7 днів
може бути достатньо в легких випадках при ретельному спостереженні за реакцією на
антибіотики і прогрессуванням хвороби на 2-3 день застосування антибіотиків (34, 35).
Ці рекомендації для антибіотиків першого ряду підтримуються попередніми дослідженнями
на чутливість до антибіотиків патогенних бактерій в Кореї. У дослідженні, проведеному
серед дітей з позалікарняними респіраторними інфекціями, етіологією яких був
S. pneumoniae в Кореї, стандартна доза амінопеніциліну не призвела до різних результатів
між чутливими і резистентними групами (17). Проте, в недавньому дослідженні з
використанням моделі фармакодинамики було передбачено, що високі дози перорального
амоксициліну будуть ефективним проти 82,6%
S. pneumoniae, виділених у здорових
41
корейських дітей, в той час як стандартної дози блив ефективними тільки в 30,4% випадків
(36).
У РКД, проведених в США, що порівнювали ефекти амоксицилін/клавуланату і
азитроміцину на бактеріоносійство носоглотки у дітей з ГСО, спостерігалося значне
зниження рівнів носійства
S. pneumoniae і
H. influenzae в обох групах, але лікуюча дія була
більш виражена в групі лікування амоксициліном/клавуланатом (37, 38). У 2008 році
дослідження, що розслідувало використання макролідів в Кореї, показало, що застосування
макролідів призвело до появи бактеріальної резистентності, і особливо до азитроміцину,
який має більш тривалий період напіврозпаду, що було тісно пов’язане з виникненням
стійкості до інших антибіотиків групи макролідів. Оскільки
S. pneumoniae, виділений у
корейських дітей, також показав швидке зростання резистентності до макролідів, необхідне
ретельний аналіз при виборі антибіотиків для лікування отиту у дітей (16). У дослідженні,
2011 року, сприйнятливість до еритроміцину була відмічена у 4,3%
S. pneumoniae, виділених
від здорових корейських дітей (36).
Рутинне застосування інших препаратів, таких як антигістамінні і протинабрякові, для
лікування ГСО у дітей показало відсутність клінічних переваг в недавньому огляді Cochrane
(39).
Таблиця 4. Рекомендовані антибактеріальні препарати для ГСО у дітей
1) Антибіотики першої лінії
Амоксицилін у високих дозах, 80–90 мг/кг/добу
Амоксицилін в стандартній дозі, 40–50 мг/кг/добу
*
Альтернативні препарати при алергії на пеніцилін
І-й тип гіперчутливості: макроліди
Не І-й тип гіперчутливості: цефалоспорини
2) Антибіотики другої лінії#
Амоксицилін/клавуланат (14:1), 80–90/6,4 мг/кг/добу
Амоксицилін/клавуланат (7:1), 40–50/6,4 мг/кг/добу + амоксицилін 40 мг/кг/день
Амоксицилін/клавуланат (4:1), 23–26/5,7–6,4 мг/кг/добу + амоксициклін 57–64
мг/кг/добу
Альтернативні препарати при алергії на пеніцилін
І-й тип гіперчутливості: кліндаміцин
Не І-й тип гіперчутливості: парентерально цефтриаксон, 50 мг/кг/добу × 3 доби
3) Антибіотики третьої лінії
Парентерально цефтриаксон, 50 мг/кг/добу × 3 доби
4) Призначення та
зміну антибіотика можна буде зробити в будь-який час, коли це буде
необхідно з урахуванням бактеріальної культури і результатів чутливості антибактеріальних
препаратів. Але бажано, щоб дослідження проводилося до початку антибіотикотерапії, що
збільшить шанси отримати позитивний результат бактеріальної культури.
5) Узагальнення лікування ГСО у дітей
Спостереження/консервативне лікування → Антибіотики першої лінії → Антибіотики
другої лінії → Антибіотики третьої лінії
В тяжких випадках#: Антибіотики другої лінії → Антибіотики третьої лінії
* Якщо старше 24-х місяців; останнім часом застосувувалися антибіотики; не відвідує
42
дитячий заклад;
# Призначення антибіотиків другої лінії при тяжкому ГСО
ДРУГА І ТРЕТЯ ЛІНІЯ АНТИБІОТИКОТЕРАПІЇ (Таблиця 4)
Ми рекомендуємо пероральний амоксицилін/клавуланат (співвідношення14: 1) 80–
90/6,4 мг/кг/добу в якості другої лінії терапії антибіотикотерапії. У тих випадках, коли друга
лінія антибіотикотерапії неефективна, парентеральне введення 50 мг/кг/день цефтриаксону
протягом 3-х днів рекомендується в якості терапії третьої лінії антибіотикотерапії (рівень
рекомендації: А). Проте, коли результати тесту чутливості антибактеріального агента
доступні, найбільш підходящий тип антибіотика може бути обраний будь-коли після
отримання результату (рівень рекомендації: B).
Неефективність антибіотикотерапія має на увазі відсутність покращення симптомів, в тому
числі оталгії, гарячки і отореї, після 48–72 год введення антибіотика. Постійні симптоми, в
тому числі ринорея, кашель або середній отит з випотом, не слід розглядати як невдачу
лікування. Інфікування організмами, стійкими до антибіотиків першого ряду, виключно
вірусну інфекція, або коінфекцію можна розглядати як причини невдачі лікування. Було
відмічено, що середній отит з випотом зберігатися в 60–70% пацієнтів після 2-х тижнів ГСО,
у 40% – через 1 місяць, і в 10–25% – через 3 місяці. Його не слід розглядати як ускладнення
ГСО, і необхідне тільки спостереження за прогресуванням хвороби. У цих випадках
персистуючого середнього отиту з випотом, потрібне безперервне спостереження в зв’язку з
бактеріологічною стійкостю і можливостю реінфекції, навіть якщо відзначається
симптоматичне покращення (40, 41).
Антибіотики другої лінії використовуються, якщо симптоматичне покращення не
спостерігається після введення антибіотика першої лінії протягом 48–72 год, і антибіотики
третього ряду після невдачі лікування антибіотиками другого ряду, щоб покращити стан
пацієнта (11). У разі невдачі лікування антибіотиками, слід провести тимпаноцентез для
взяття мікробної культури з визначенням чутливості до антибактеріального препарата. Ці
процедури і зміни антибіотика можуть бути проведені в будь-який час в міру необхідності,
але краще, щоб це було зроблено до початку лікування антибіотиками через збільшення
можливості негативних результатів посіву бактеріальної культури після введення
антибіотика. Методи для отримання зразків бактеріальної культури включають
тимпаноцентез, відбір проб отореї із зовнішнього слухового каналу з перфорованої БП, а
також забір з носоглотки слизу трансназальним шляхом (14). Якщо терпимо, тимпаноцентез
може полегшити оталгію у тяжких випадках, і процедура може допомогти у виборі
антибіотиків за допомогою мікробної культури з визначенням чутливості до
антибактеріального агента після невдачі лікування антибіотиками першої лінії (27).
У випадках персистенції симптоматики після призначення макролідів пацієнтам з I типом
реакції гіперчутливості до пеніцилінів (наприклад, кропив’янка, анафілактичний шок),
кліндаміцин може використовуватися в якості антибіотика другої лінії. У випадку реакцій
гіперчутливості не I-го типу, цефалоспорини, такі як цефуроксим, цефпрозил, цефподоксим,
цефдинір і цефдіторен можуть бути використані в якості антибіотиків першої лінії; при
персистуванні симптомів можна парентерально приймати цефтриаксон протягом 3-х днів.
Проте, оскільки рівень резистентності
S. pneumoniae, ідентифікований в Кореї, до нових
макролідів перевищує 70%, рекомендується посів бактеріальної культури, якщо дитина
дозволить, бажано перед першим введенням антибіотиків (32). Рецидив хвороби, викликаний
одним і тим же збудником, був помічений лише в 28% випадків рецидиву середнього отиту
після лікування антибіотиками.
Коментар робочої групи: станом на 16 вересня 2016 року препарати цефпрозилу
(АТС-код: J01DC10), цефдиніру (АТС-код: J01DD15), цефдіторену (АСТ-код: J01DD16) в
Україні не зареєстровані.
43
THE DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA
Ключовий практичний висновок 4А
У разі, якщо було прийнято рішення лікувати ГСО антибіотиками, клініцисти повинні
призначати амоксицилін при тому що: дитина не отримувала амоксицилін впродовж
останніх 30-ти днів, АБО дитина одночасно не має гнійного кон’юнктивіту, АБО
дитина не має алергії на пеніциліни. (Рівень доказовості: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 4А
Сукупний рівень доказовості Клас В
Переваги
Ефективний антибіотик для більшості дітей з ГСО.
Недорогий, безпечний, з прийнятним смаком та вузьким
антимікробним спектром.
Ризики, шкода, вартість
Неефективний проти β-лактамазо-продукуючих організмів.
Побічні ефекти амоксициліну.
Оцінка співвідношення
Переважання користі.
користі/шкоди
Оціночні судження
Краще застосовувати препарат, що має адекватну ціну,
прийнятний смак та вузький антибактеріальний спектр.
Навмисна невизначеність
Лікар повинен визначити, чи дійсно в пацієнта алергія на
пеніцилін.
Роль побажань пацієнтів
Повинні братися до уваги у випадках негативного досвіду
застосування амоксициліну.
Виключення
Пацієнти з підтвердженою алергією на пеніцилін.
Ступінь
Рекомендація
Ключовий практичний висновок 4В
Якщо хворого з ГСО вирішено лікувати антибіотиками, лікар-клініцист має
призначити антибіотик із додатковим захистом від бета-лактамаз за умови наявності у
пацієнтів з факторами ризику резистентності (вік до 3 років, відвідування закладів із
денним перебуванням у групах дітей, наявність старших рідних брата/сестри, недавній
прийом антибіотика (до 1 місяця), не було антипневмококової вакцини, рецидив ГСО в
анамнезі, стійкий до дії амоксициліну), а також у пацієнтів, які мають синдром «отит-
кон’юнктивіт». (Рівень доказовості: С. Ступінь: рекомендація).
Профіль ключового практичного висновку: КПВ 4В
Сукупний рівень доказовості Ступінь В
Переваги
Ефективний проти β-лактамазо-продукуючих організмів.
Ризики, шкода, вартість
Вартість антибіотику. Більша кількість побічних ефектів.
Оцінка співвідношення
Переважання користі.
користі/шкоди
Оціночні судження
Ефективність важливіша за смак.
Навмисна невизначеність
Немає.
Роль побажань пацієнтів
Занепокоєння щодо побічних ефектів та смаку.
Виключення
Пацієнти з підтвердженою алергією на пеніцилін.
Ступінь
Рекомендація
44
Ключовий практичний висновок 4С
Лікар-клініцист має повторно оцінити стан здоров’я дитини, якщо особа, що наглядає
за хворим, повідомляє про погіршення стану хворого або відсутність терапевтичної
відповіді на лікування антибіотиками протягом 48–72 годин, та визначити необхідність
зміни стратегії лікування. (Рівень доказовості: клас В. Ступінь: рекомендація).
Профіль ключового практичного висновку: КПВ 4С
Сукупний рівень доказовості Ступінь В
Переваги
Ідентифікація дітей, в яких ГСО може бути викликаний
патогенами, резистентними до зазначених вище
антибіотиків.
Ризики, шкода, вартість
Вартість. Час, необхідний пацієнту та лікарю для внесення
змін. Потенційна необхідність парентерального препарату.
Оцінка співвідношення
Переважання користі.
користі/шкоди
Оціночні судження
Немає.
Навмисна невизначеність
«Переоцінка» не визначена. Лікар може сам визначити
метод оцінки.
Роль побажань пацієнтів
Обмежена.
Виключення
Покращення зовнішнього вигляду БП.
Ступінь
Рекомендація
Мета розділу
Якщо для лікування дитини з ГСО в якості початкового лікування або після періоду
спостереження вирішено застосовувати антибіотик, лікар повинен обрати препарат, що з
великою вірогідністю буде ефективним проти більшості патогенів бактеріальної етіології з
урахуванням вартості, смаку, користі та можливих побічних ефектів. В цьому розділі
пропонуються антибіотики першої та другої лінії, які найкраще відповідають цим критеріям,
врівноважуючи користь та шкоду.
Зміни до настанови AAP/AAFP з лікування ГСО 2004 року
Незважаючи на нові дані щодо дії семивалентної антипневмококової кон’югованої вакцини
(PCV7) та оновлені дані досліджень in vitro щодо сприйнятливості бактеріальних патогенів,
здатних викликати ГСО, рекомендації щодо антибіотиків першої лінії залишаються без змін
з 2004 року. Ця настанова містить переглянуті рекомендації відносно алергії на пеніцилін на
основі нових даних. Відмічено підвищену мультирезистентність штамів пневмококів.
Мікробіологія
До мікроорганізмів, виявлених в середньому вусі при ГСО, належать патогенні бактерії та
респіраторні віруси.107–110 ГСО найчастіше виникає внаслідок вірусної інфекції верхніх
дихальних шляхів.111–113 Інфекція призводить до запалення/дисфункції євстахієвої труби,
негативного тиску в середньому вусі та переміщення секрету, що містить патогенні бактерії
та вірус, викликавший інфекцію верхніх дихальних шляхів, з носоглотки в простори
середнього вуха. Застосовуючи комплексні і точні мікробіологічні тести, можна виявити
бактерії та/або віруси у рідині середнього вуха майже у 96% випадків ГСО (у 66% –
поєднання бактерій та вірусів, у 27% – тільки бактерії та у 4% – тільки віруси).114
Дослідження з використанням не таких точних та комплексних мікробіологічних аналізів
дали менше позитивних результатів щодо бактерій та значно менше позитивних результатів
щодо вірусів.115–117 Три найпоширеніші бактеріальні патогени при ГСО – це S pneumoniae,
45
нетиповані штами
Haemophilus influenzae та
Moraxella catarrhalis.111
Streptococcus pyogenes (β-гемолітичні стрептококи групи А) обумовлюють менше 5% випадків ГСО. Кількість
випадків ГСО з патогенними бактеріями, виділеними з рідини середнього вуха, варіюється в
залежності від методу посіву бактерій, транспортного середовища та чіткості визначення
ГСО. В серії звітів із США та Європи за 1952–1981 та 1985–1992 рр. середній показник
випадків з бактеріальними патогенами, виділеними з рідини середнього вуха, становив 69%
та 72%, відповідно.118 Серія досліджень, проведених Групою з вивчення середнього отиту
Університету Пітсбурга показала наявність бактеріальних патогенів в рідині середнього вуха
у 84% серед 2807 випадків ГСО.118 Дослідження, в яких застосовувалися чіткіші отоскопічні
критерії та/або використовувався матеріал з середнього вуха, поміщений на твердий агар з
додаванням рідкої транспортної середи, зареєстрували показник виявлення патогенних
бактерій в ексудаті середнього вуха в діапазоні від 85% до 90%.119–121 Застосовуючи
відповідні чіткі діагностичні критерії, ретельну роботу зі матеріалом із середнього вуха та
точні мікробіологічні методи, можна пересвідчитись, що переважна більшість випадків ГСО
обумовлена або лише патогенними бактеріями, або їх комбінацією з вірусними патогенами.
Згідно більш раннім звітам, найпоширенішим серед бактеріальних патогенів ГСО був
S. pneumoniae. З початком загального використання PCV7 в 2000 році поширеність 3
основних патогенів середнього вуха змінилася.105 В перші кілька років після введення PCV7
найбільш поширеним ізольованим патогеном середнього вуха став штам H influenzae,
випередивши
S. pneumoniae.122,123 Невдовзі після цього було зафіксовано перехід до
серотипів
S. pneumoniae, що не входять до складу PCV7.124 Pichichero та співав.104 пізніше
звітували, що 44% з 212 випадків ГСО, зареєстрованих в 2002–2006 рр., були спричинені
H. influenzae, а 28% були спричинені штамами
S. pneumoniae, велика кількість з яких були
високорезистентними. В зазначеному дослідженні у більшості випадків (77%) наставали
рецидиви або невдачі початкового лікування. Більш пізній звіт125 з даними від 2007–2009 рр.,
через 6–8 років після введення PCV7 в США, показав, що штами
S. pneumoniae, які входять
до складу PCV7, фактично зникли з рідин середнього вуха у дітей з ГСО, які раніше були
вакциновані. Проте частота виділення з рідин середнього вуха серотипів
S. pneumoniae, що
не входять до складу PCV7, загалом зросла; це майже зрівняло виявлення у дітей з ГСО
штамів
S. pneumoniae та
H. influenzae.
В дослідженні тимпанопункції протягом 4 сезонів захворювань дихальних шляхів в
особистій практиці процент S pneumoniae відноcно H influenzae спочатку знизився. В 2005-
2006 рр. (N=33) 48% бактерій складали штами
S. pneumoniae і 42% –
H. influenzae. В 2006-
2007 рр. (N=37) співвідношення було однаковим – 41%. В 2008 р. (N=34) 35% складали
штами
S. pneumoniae, а 59% –
H. influenzae. В 2009 р. (N=24) співвідношення було 54% і 38%
відповідно, із зростанням помірно чутливих і нечутливих штамів
S. pneumoniae.126 Дані щодо
носоглоткової колонізації в дітей з ГСО, вакцинованих PCV7, показали тривалу присутність
колонізації
S. pneumoniae. Revai та співав.127 довели відсутність різниці в показнику
колонізації
S. pneumoniaе серед дітей з ГСО, які були не вакциновані, не повністю
імунізовані або повністю вакциновані PCV7. В дослідженні під час вірусної інфекції верхніх
дихальних шляхів, включаючи головним чином PCV7-вакцинованих дітей (віком від 6
місяців до 3 років),
S. pneumoniaе було виявлено в 45,5% із 968 носоглоткових мазків,
H. influenza було виявлено в 32,4%, а
M. catarrhalis – в 63,1%.128 Дані показують, що
носоглоткова колонізація у дітей, вакцинованих PCV7, все частіше спричиняється
серотипами
S. pneumoniaе, що не входять до складу вакцини.129–132 З використанням
нещодавно ліцензованої 13-валентної пневмококової кон’югованої вакцини (PCV13)133 види
носоглоткових колонізацій та інфекцій з поширеними бактеріальними патогенами ГСО
продовжать змінюватися.
Дослідники намагалися передбачити тип патогенної бактерії ГСО на основі клінічної
тяжкості, але результати не були багатообіцяючими. Доведено, що
S. pyogenes частіше
виявляються у старших дітей134 і викликають тяжче запалення середнього вуха та БП, більшу
частоту спонтанного розриву БП та частіше прогресування до гострого мастоїдиту у
46
порівнянні з бактеріальними патогенами.134–136 Щодо отриманих клінічних даних у випадках
із штамами
S. pneumoniae та нетипованими штамами
H. influenzae, деякі дослідження
припускають, що ознаки і симптоми ГСО, спричиненого
S. pneumoniaе, можуть бути більш
тяжкими (гарячка, сильний вушний біль, випинання БП), ніж ті, що спричинені іншими
патогенами.44,121,137 Ці висновки були спростовані результатами досліджень, які виявили, что
ГСО, спричинені нетипованими штамами H influenzае, супроводжуються двобічним ГСО та
тяжчим запаленням БП.96,138 Leibovitz та співав.139 дійшли висновку в дослідженні за участю
372 дітей з ГСО, спричиненим H influenzae (N=138), S pneumoniae (N=64) та комбінацією H
influenzae та S pneumoniae (N=64), що клінічні/отологічні показники не дають можливості
розпізнати бактеріальну причину ГСО. Проте суттєво відрізнялися клінічні/отологічні
показники у випадках негативних та позитивних результатів бактеріальних посівів.
Дослідження ексудатів середнього вуха у 82 випадках бульозного мірингіту в 97% дало
позитивний результат бактеріального посіву, в першу чергу це стосувалося S pneumoniae. В
протилежність більш раннім твердженням, мікоплазма при цьому рідко виявляється
етіологічною причиною.140 Точне прогнозування бактеріальної причини ГСО на основі
клінічної картини, без бактеріального посіву ексудатів середнього вуха, неможливе, але в
деяких ситуаціях можна передбачити конкретну етіологію. Опубліковані докази дають змогу
припустити, что ГСО, який супроводжується кон’юнктивітом (синдром отиту-
кон’юнктивіту), спричиняється скоріше нетипованими штамами H influenzae, ніж іншими
бактеріями.141–143
Чутливість бактерій до антибіотиків
Вибір антибіотику для лікування ГСО базується на передбачуваному типі бактерій та їх
сприйнятливості до антибіотику, хоча беруться до уваги також клінічна фармакологія,
результати клінічних і мікробіологічних аналізів та прогнозована комплаєнтність до
препарату. Ранні дослідження пацієнтів з ГСО показують, що серед дітей, яких не лікували
антибіотиками, при первинному тимпаноцентезі в 19% було виявлено
S. pneumoniae та у 48%
–
H. influenzae. Під час другого тимпаноцентезу, через 2–7 днів, бактерій не було виявлено.144
Приблизно у 75% дітей, інфікованих
M. catarrhalis, бактерій не було виявлено навіть після
лікування амоксициліном, антибіотиком, до якого цей штам не сприйнятливий.145,146
Чутливість до антибіотиків основних бактеріальних патогенів ГСО продовжує змінюватись,
але даних щодо патогенів середнього вуха стало недостатньо, оскільки тимпаноцентез
зазвичай не проводиться при дослідженні дітей з неускладненим ГСО. Найбільше доступних
даних отримується при випадках стійкого або рецидивуючого ГСО. Сучасні дані з декількох
центрів США показують, що до звичайної дози амоксициліну (40 мг/кг/день) та високої дози
(80–90 мг/кг/день, поділені на два прийоми) чутливі відповідно близько 83% і 87% ізолятів S
pneumoniae в усіх вікових группах.130,147–150 В педіатричній практиці ізолятів менше за
кількістю, і в основному до них належать вушні ізоляти, виділені при випадках
рецидивуючого і стійкого ГСО, з великою кількістю мультирезистентних штамів S
pneumoniae, найчастіше тих серотипів, що не входять до складу вакцин, і частота та
значимість яких останнім часом зросла.104
Амоксицилін у високих дозах досягає такого рівня у рідині середнього вуха, який перевищує
мінімальну інгібіторну концентрацію (МІК) для всіх серотипів
S. pneumoniae, стійких до
пеніциліну (МІК пеніциліну 0,12–1,0 мкг/мл), і багатьох, але не всіх високорезистентних
серотипів (МІК пеніциліну ≥ 2 мкг/мл) при тривалішому інтервалі дозування, та демонструє
підвищену бактеріологічну та клінічну ефективність порівняно із звичайною дозою.151–153
Hoberman та співав.154 довели підвищену ефективність високих доз амоксицилін-клавуланата
у знищенні
S. pneumoniae (96%) в середньому вусі на 4–6 день лікування порівняно з
азитроміцином.
Очікується, що чутливість
S. pneumoniae до антибіотиків продовжить змінюватися з
початком застосування PCV13, кон’югованої вакцини, що містить 13 серотипів
S. Pneumoniae.133,155,156
Широке застосування PCV13 потенційно може зменшити
47
поширеність захворювань, спричинених мультирезистентними пневмококовими серотипами
та знизити необхідність використання високих доз амоксициліну або амоксицилін-
клавуланату при лікуванні ГСО.
Деякі ізоляти
H. influenzae продукують фермент β-лактамазу, що робить ізолят стійким до
пеніцилінів. Сучасні дані досліджень з джерел, не пов’язаних з ГСО та з різних географічних
локацій показують, що 58–82% ізолятів
H. influenzae чутливі до звичайних та високих доз
амоксициліну.130,147,148,157,158 Ці дані продемонстрували значне зниження β-лактамазо-
продукуючого штаму
H. influenzae, порівняно з даними, викладеними в настанові з лікування
ГСО 2004 року.
Загальнонаціональні дані дають можливість припустити, що 100% штамів
M. catarrhalis,
виділених з верхніх дихальних шляхів, є β-лактамазо-позитивними, але залишаються
сприйнятливими до амоксицилін-клавуланату.159 Високий показник спонтанної клінічної
регресії в дітей з ГСО, викликаним
M. catarrhalis, яких лікували амоксициліном, зменшує
стурбованість щодо спектру дії препаратів першої лінії для цього мікроорганізму.145,146 ГСО,
викликаний
M. catarrhalis, рідко прогресує до гострого мастоїдиту або внутрішньочерепних
інфекцій.102,160,161
Коментар робочої групи: в світі існує практика проведення багатоцентрових
досліджень, які виконуються за єдиним протоколом із залученням великої кількості країн. В
тому випадку, якщо дослідження присвячене вивченню антибіотикорезистентності, то
дані, отримані в цьому дослідженні, лягають в основу створення регіональних рекомендацій
щодо емпіричної антибіотикотерапії. Одним з наймасштабніших епідеміологічних
досліджень антибіотикорезистентності є дослідження SOAR (Survey of Antibiotic
Resistance). Це дослідження проводиться в декількох регіонах Землі. Кількість країн-
учасників
щороку
збільшується.
В
2010
році
протокол
дослідження
антибіотикорезистентності S. pneumoniae та H. influenzae було схвалено Центральною
комісією з питань етики МОЗ України. Восени 2010 року Україна приєдналась до цього
дослідження.
Дослідження
проводиться
з
метою
отримання
даних
щодо
антибіотикорезистентності в досліджуваній місцевості (країні).
Результати дослідження свідчать про те, що існують відмінності у чутливості
бактерій до антибіотиків, навіть між географічно близькорозташованими країнами. Це
свідчить про необхідність проведення локальних досліджень, оскільки екстраполяція даних з
інших країн може стати причиною помилки. В такому разі емпірична антибіотокотерапія
виявиться недостатньо ефективною.
За результатами міжнародного дослідження SOAR, що триває з 2002р., до якого в
2010 р. приєдналась Україна 87,3% штамів S. pneumoniae були чутливими до пеніциліну
(критерії CLSI, 2012 р.). Слід зазначити, що в Україні 100% штамів S. pneumoniae виявилися
чутливим до амоксициліну, захищеного клавулановою кислотою, левофлоксацину і
цефтриаксону. Дещо нижчі показники були відмічені для цефуроксиму (95,5%), цефіксиму
(88,8%) та ципрофлоксацину (89,6%). До кларитроміцину та еритроміцину 11,9% штамів S.
pneumoniae виявилися нечутливими; 10,4% виявилися резистентними до азитроміцину.
Всі 100% штамів H. influenzae виявилися чутливими до амоксициліну, захищеного
клавулановою кислотою, азитроміцину, цефіксиму, цефтриаксону, цефуроксиму,
ципрофлоксацину та левофлоксацину. Дещо нижчі показники були відмічені для ампіциліну
(94,0%), кларитроміцину (98,5%) та комбінації триметоприм + сульфаметоксазол (59,7%).
Локальні дані чутливості мікроорганізмів повинні відігравати провідну роль при
призначенні антибактеріальної терапії. Отримані в дослідженні SOAR дані свідчать, що
100% штамів Streptococcus pneumoniae в Україні чутливі до амоксициліну/клавуланату. Це
підтверджує доцільність використання амоксициліну/клавуланату в якості емпіричної
терапії респіраторних інфекцій. Враховуючи мінімальні показники резистентності
пневмококу до цефуроксиму (4,5% за результатами SOAR), є можливість призначати і
даний препарат для емпіричної терапії другого ряду. Застосування цефалоспоринів ІІІ-го
48
покоління та фторхінолонів в якості препаратів стартової терапії в лікування
респіраторних інфекцій не є раціональним. Враховуючи високі показники резистентності
пневмококів, виділених у пацієнтів України з респіраторними захворюваннями, до макролідів,
застосування даних препаратів для емпіричної терапії респіраторних інфекцій не може
вважатися раціональним. [Y. Feshchenko, A. Dzyublik, T. Pertseva et al. Antibacterial resistance
among Streptococcus pneumoniae and Haemophilus influenzae from Ukraine. Results from the
Survey of Antibiotic Resistance (SOAR) 2011–2013. 2014; 24th ECCMID, P-1589].
THE DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA, 2013
Антибіотикотерапія
Амоксицилін у високих дозах рекомендують в якості терапії першої лінії для більшості
пацієнтів, хоча є й інші клінічно ефективні препарати (Таблиця 5). Обгрунтування
застосування амоксициліну пов’язано з його ефективністю проти поширених бактеріальних
патогенів ГСО, а також з його безпечністю, низькою вартістю, прийнятним смаком та
вузьким мікробіологічним спектром.145,151 У дітей, які приймали амоксицилін в останні 30
днів, або мають супутній кон’юнктивіт або тих, для яких спектр дії препарату має
поширюватися на β-лактамаза-позитивні штами H influenzae та M catarrhalis,лікування
повинне починатися з високої дози амоксицилін-клавуланату (90 мг/кг/день амоксициліну і
6,4 мг/кг/день клавуланату, співвідношення амоксициліну до клавуланату 14:1; доза має бути
поділена на два прийоми, що зменшує вірогідність виникнення діареї в порівнянні з іншими
концентраціями амоксицилін-клавуланату).162
До альтернативних початкових антибіотиків належать цефдинір (14 мг/кг на день в 1 чи 2
прийоми), цефуроксим (cefuroxime) (30 мг/кг на день в 2 прийоми), цефподоксим (10 мг/кг на
день в 2 прийоми) або цефтриаксон (50 мг/кг, вводять внутрішньом’язово). Важливо
відмітити, що альтернативні антибіотики різняться в своїй ефективності проти патогенів
ГСО. Наприклад, в США сучасні дані доводять, що сприйнятливість in vitro штамів S
pneumoniae до цефдиніру та цефуроксиму становить 70–80%, порівняно з 84–92%
ефективності амоксициліну.130,147–149 In vitro ефективність цефдиніру та цефуроксиму проти
H influenzae становить приблизно 98% порівняно з 58% ефективності амоксициліну та майже
100% ефективності амоксицилін-клавуланату.158 Мультицентрове подвійне відкрите
дослідження цефдиніру із застосуванням тимпаноцентезу при рецидивуючому ГСО,
викликаному
H. influenzae, продемонструвало знищення бактерій у 72% пацієнтів.163
Згідно сучасних даних можна припустити, що у дітей з алергією на пеніцилін перехресна
чутливість між пеніцилінами та цефалоспоринами нижча, ніж вважалося раніше.164–167
Вищезгаданий показник перехресної чутливості до цефалоспоринів серед пацієнтів з
алергією на пеніцилін (приблизно 10%), скоріше за все, завищений. Показник базувався на
даних, зібраних та переглянутих протягом 1960-х та 1970-х років. В дослідженні було
проаналізовано об’єднані дані 23-х досліджень за участю 2400 пацієнтів з підтвердженою
алергією на пеніцилін в анамнезі та 39000 без алергії на пеніцилін. Це дозволило зробити
висновок, що багато пацієнтів з алергією на пеніцилін в анамнезі не мають імунологічної
реакції на пеніцилін.166 Хімічна структура цефалоспорину визначає ризик перехресної
активності між конкретними агентами.165,168 Ступінь перехресної чутливості вищий між
пеніцилінами та цефалоспоринами першого покоління, але з цефалоспоринами другого та
третього покоління ця реактивність незначна. Через різницю в хімічних структурах дуже
маловірогідно, що цефдинір, цефуроксим, цефподоксим та цефтриаксон мають перехресну
чутливість з пеніциліном.165 Незважаючи на це, Об’єднана цільова група з практичних
параметрів, Американська академія алергії, астми та імунології, Американський коледж
алергії, астми та імунології та Об’єднана рада алергії, астми та імунології169 заявили, що
«лікування цефалоспоринами пацієнтів з алергією на пеніцилін в анамнезі, виключаючи осіб
з тяжкою реакцією в анамнезі, виявляє показник реакції 0,1%». Вони рекомендують
цефалоспорин у випадках без тяжкої та/або нещодавньої алергічної реакції на пеніцилін,
якщо недоступні шкірні тести.
49
Макроліди, такі як еритроміцин та азитроміцин, мають обмежену ефективність як проти
H. influenzae, так і проти
S. Pneumoniae.130,147–149 Кліндаміцин не ефективний проти
H. influenzae. Кліндаміцин окремо (30–40 мг/кг на день в 3 прийоми) можна застосовувати
при підозрі на пеніциліно-резистентний S pneumoniae; однак, цей препарат, скоріше за все,
не будет ефективним проти мультирезистентних серотипів.130,158,166
Деякі з цих суспензій антибіоків є трохи несмачними або дуже неприємними на смак та
можуть призвести до ухилення або активного неприйняття з випльовуванням суспензії.
Смакові
характеристики
антибіотичних
суспензій
порівнювалися
у
багатьох
дослідженнях.170–172 Смак окремих антибіотичних суспензій, таких як цефуроксим,
цефподоксим та кліндаміцин, можна покращити шляхом додавання, наприклад, шоколадних
або полуничних ароматизаторів, щоб замаскувати гіркий смак або неприємний
післясмак.172,173 У пацієнтів із стійким блюванням або тих, хто не сприймає оральних
препаратів навіть із замаскованим смаком, цефтриаксон (50 мг/кг, введений
внутрішньом’язово або внутрішньовенно) продемонстрував ефективність при початковій або
повторній антибіотикотерапії ГСО.174,175 Хоча одноразова ін’єкція цефтриаксону при
лікуванні ГСО дозволена Управлінням США з санітарного нагляду за якістю харчових
продуктів та медикаментів, результати подвійного дослідження тимпаноцентезу (до та через
3 дні після одноразового введення цефтриаксону), проведеного Leibovitz та співав.,175
припускають, що протягом 5–7 днів після першої ін’єкції може потребуватися додаткова
доза цефтриаксону для попередження повторного інфікування середнього вуха.
Таблиця 5. Рекомендовані антибіотики для початкового або відтермінованого
лікування та для пацієнтів з невдалою початковою антибіотикотерапією
Антибіотикотерапія
після
відсутності
відповіді
Початкова антибіотикотерапія при ГСО чи після (оцінка через 48–72 годин) на початкову
спостереження
антибіотикотерапію
Рекомендована
перша Альтернативне лікування
Рекомендована
перша Альтернативне лікування
лінія терапії
лінія терапії
Амоксицилін
(80–90 Цефдинір (14 мг/кг/день в Амоксициліну клавуланат Цефтриаксон (3 дні), або
мг/кг/день)
1
або
2
прийоми), (90
мг/кг/день
за кліндаміцин
(30–40
цефуроксим
(30 амоксициліном,
з
6,4 мг/кг/день в 3 прийоми), з
мг/кг/день в 2 прийоми),
мг/кг/день
за або без цефалоспорином
цефподоксим
(10 клавулановою кислотою)
другої
або
треттьої
мг/кг/день в 2 прийоми),
генерації
або
АБО
АБО
цефтриаксон
(50
Амоксициліну
мг/кг/день
Цефтриаксон
(50 Кліндаміцин в поєднанні
клавуланат
a
(90 внутрішньом’язево
або мг/кг/день
з цефалоспорином другої
мг/кг/день
за внутрішньовенно
внутрішньом’язево
або або треттьої генерації
амоксициліном,
з
6,4 впродовж 1–3 днів)
внутрішньовенно
Тимпаноцентез
b
мг/кг/день
за
впродовж 3-х днів)
Консультація спеціаліста
b
клавулановою кислотою
)
a Може розглядатися для пацієнтів, які отримували амоксицилін в попередні 30 днів АБО які мають ото-
кон’юнктивальний синдром.
b Виконайте тимпаноцентез/дренування, якщо ви спеціаліст з цієї процедури, або знайдіть можливість
проконсультуватися зі спеціалістом (оториноларингологом) щодо тимпаноцентезу/дренування. Якщо в
результаті тимпаноцентезу виявляються мультирезистентні бактерії, шукайте можливість проконсультуватися з
лікарем-інфекціоністом.
Коментар робочої групи: станом на 31 травня 2016 року препарати цефдиніру
(АТС-код: J01DD15) в Україні не зареєстровані.
Також робоча група вважає за потрібне навести інформацію щодо показань для
міринготомії у дітей з ГСО, що рекомендовані в Україні [КосаковскийА.Л., Юрочко Ф.Б.
Острый средний отит у детей – предложения относительно усовершенствования
50
современного протокола диагностики и лечения. Детская оториноларингология (Москва)
№2,2012, стр 15-17 (з доповненнями)]
Група показань Показання
За перебігом
Тривала гарячка й біль вуха
Безсоння впродовж ≥2 ночей
Загальний стан дитини тяжкий або середньої тяжкості
Бурхливий перебіг ГСО
Рецидивуючий або персистуючий середній отит
Місцеві
Різке випинання БП
Згладженість завушної складки
Відстовбурчення вушної раковини
Болючість при перкусії соскоподібного відростка
Загальні
Виражені зміни в загальному аналізі крові
Вік дитини до 3-х місяців
Неефективність антибіотикотерапії
Системні
захворювання
дитини,
які
супроводжуються
імунодефіцитами
Невдача початкової антибактеріальної терапії
Під час лікування ГСО за допомогою антибактеріальних препаратів клінічне покращення
стану дитини має спостерігатись через 48–72 години. Упродовж 24 годин з моменту
діагностування ГСО самопочуття дитини може погіршитися. Покращення самопочуття
пацієнта має спостерігатися впродовж наступних 24 годин. Підвищена температура тіла має
знизитися упродовж 48–72 годин. Дратівливість і нервовість дитини зменшуються або
зникають, нормалізується режим сну й пиття.176,177 Якщо впродовж 48–72 годин стан
пацієнта не покращується, це може свідчити про наявність іншого захворювання, супутньої
вірусної інфекції або резистентності бактерій-збудників до обраної терапії.
У деяких дітей, хворих на ГСО, стійкі симптоми впродовж 48–72 годин після розпочатої
первинної антибактеріальної терапії можуть свідчити про комбінований бактеріально-
вірусний характер інфекції, що пояснює стійкість симптомів на тлі адекватної
антибактеріальної
терапії.109,178,179
Висновки
щодо
взаємозв’язку
клінічних
і
бактеріологічних наслідків хвороби мають суперечливий характер. Результати деяких
досліджень вказують на позитивний взаємозв’язок: присутність бактерій у середньому вусі
супроводжується стійкими клінічними симптомами у 86–91% випадків.180,181 Інші
дослідження свідчать, що у 42–49% дітей з ГСО стійкі симптоми зберігаються, незважаючи
на стерильність рідини у середньому вусі.123,182 У деяких випадках при помірно виражених
стійких симптомах заміна антибактеріального препарату на інший не потрібна.
Заміна антибактеріального препарату доцільна за наявності у дитини з ГСО стійких
симптомів високого ступеню тяжкості та незадовільних результатів огляду середнього вуха
після первинного лікування (таблиця 5). Якщо стан дитини не покращився після первинного
лікування амоксициліном, слід призначити амоксицилін-клавуланат. Пацієнтам, які
отримували амоксицилін-клавуланат або цефалоспорини третього покоління, можна
призначити внутрішньом’язові ін’єкції цефтриаксону (50 мг/кг ваги тіла). При лікуванні
ГСО, стійкого до антибактеріальної терапії, застосування цефтриаксону впродовж 3 днів є
більш ефективним, ніж одноденний прийом.175 Незважаючи на терапевтичну користь
триметоприм-сульфаметоксазолу та еритроміцин-сульфісоксазолу при лікуванні ГСО,
моніторингові дослідження розповсюдження пневмококової інфекції вказують на значну
резистентність до цих комбінованих препаратів.130,149,183 Отже, за відсутності відповіді на
лікування амоксициліном, застосування триметоприм-сульфаметоксазолу184 та еритроміцин-
сульфісоксазолу для відповідної терапії є недоцільним.
За відсутності покращення клінічного стану пацієнта після лікування кількома
антибактеріальними препаратами, слід розглянути доцільність проведення тимпаноцентезу
51
та мікробіологічного дослідження рідини з середнього вуха з метою виявлення
мікроорганізмів та визначення їх чутливості. Якщо нема можливості зробити тимпаноцентез,
можна призначити кліндаміцин або кліндаміцин у комбінації з антибактеріальним
препаратом, ефективним проти нетипованих серотипів
H. influenzae та
M. catarrhalis,
наприклад, цефдинір, цефіксим або цефуроксим.
Оскільки
S. pneumoniae серотип 19A зазвичай є мультирезистентним зі стійкістю до
кліндаміцину,104,149 можна призначити антибіотики нового покоління, які не ухвалені FDA
для застосування в терапії ГСО, наприклад, левофлоксацин або лінезолід.185–187
Левофлоксацин належить до класу хінолонів, його застосування у дітей не схвалено FDA.
Лінезолід є ефективним препаратом при лікуванні інфекцій, викликаних резистентними
грам-позитивними бактеріями. Його застосування в терапії ГСО не затверджено FDA, до
того ж він має значну вартість. Дітям з неодноразовою невдачею лікування слід провести
тимпаноцентез і подальше мікробіологічне дослідження рідини методом Грама,
культивування бактерій та визначення їх чутливості до антибактеріальних препаратів. Перед
призначенням препаратів, нетипових для лікування ГСО, таких як левофлоксацин або
лінезолід, лікар може призначити консультацію вузьких спеціалістів, наприклад,
інфекціоніста та отоларинголога, який проведе тимпаноцентез і дренування порожнини
середнього вуха.
Якщо зробити тимпаноцентез неможливо, зразок для визначення патогенних мікроорганізмів
у середньому вусі та їх чутливості до антибіотиків можна отримати з носоглотки. Майже всі
патогенні збудники інфекцій середнього вуха походять від патогенних мікроорганізмів, що
колонізують носоглотку, але не всі патогенні бактерії проникають у середнє вухо,
викликаючи ГСО. Прогностичне значення позитивного результату (тобто вірогідність того,
що бактерії, отримані в результаті посіву мазка з носоглотки у хворих на ГСО, викликають
запалення у середньому вусі) становить від 22 до 44% для
S. pneumoniae, від 50% до 71% –
для нетипованих серотипів
H. influenzae та від 17% до 19% – для
M. cararrhalis.
Прогностичне значення негативного результату (тобто вірогідність того, що бактерії, не
отримані в результаті посіву мазка з носоглотки, не викликають ГСО) становить від 95% до
99% для всіх трьох збудників, зазначених вище.188,189 Отже, швидше за все, якщо в результаті
культивації мікроорганізмів з матеріалу, отриманого в носоглотці, специфічних бактерій не
знайдено, ГСО викликаний не ними. Наприклад, відсутність
S. pneumoniae за результатами
культуральної діагностики свідчить на користь відсутності мультирезистентних бактерій і
відсутності потреби у застосуванні левофлоксацину або лінезоліду. З іншого боку, якщо з
матеріалу з носоглотки методом посіву було отримано
S. pneumoniae, результати
дослідження чутливості мікроорганізмів сприятимуть підбору адекватної терапії.
Тривалість лікування
Оптимальна тривалість лікування пацієнтів з ГСО не визначена; загальноприйнятий курс
лікування становить 10 днів, за аналогією до терміну лікування стрептококового
фаринготонзиліту. За результатами деяких досліджень, у дітей віком до 2-х років 10-денний
курс лікування дає кращі результати, ніж коротші курси.162,190–194 Отже, дітям до 2-х років і
дітям із важкими симптомами рекомендовано призначення 10-денного курсу терапії. У дітей
віком від 2-х до 5-ти років і дітей зі слабко або помірно вираженими симптомами 7-денний
курс лікування виявляється порівняно ефективним. У дітей віком від 6-ти років зі слабко або
помірно вираженими симптомами адекватний курс лікування становить від 5-ти до 7-
ми днів.
CLINICAL PRACTICE GUIDELINE FOR DIAGNOSIS AND MANAGEMENT OF ACUTE
OTITIS MEDIA (AOM) IN CHILDREN, 2015
21. ЛІКУВАННЯ
Клінічне питання 21-4 Як довго слід застосовувати антибактеріальний препарат?
Рекомендація:
52
У випадках середнього та тяжкого ступеню тяжкості, пацієнта слід лікувати 5 днів
антибактеріальним препаратом та на третій або четвертий день лікування оцінити перебіг
хвороби. (Ступінь рекомендації: A).
Дослідження, використані для даної рекомендації: Ovetchkine та співав., 2003 (Level Ia),
Kozyrskyj та співав., 2000 (рівень Ia), Bezakova та співав., 2009 (рівень Ib), Gulani та співав.,
2010 (рівень Ia), Hoberman та співав., 2011 (рівень Ia), Tahtinen та співав., 2011 (рівень Ib).
Вихідні дані
Хоча курс антибактеріальної терапії зазвичай становить 5, 7 або 10 днів, тривалість
рекомендують визначати відповідно до патогенності бактерій та ефективності
антибіотикотерапії.
Коментарі
У проспективному дослідженні Pichichero та співав. (2001) оцінювали 5-ти, 7-ми та 10-ти
денний курс антибактеріальної терапії ГСО. Хоча з’ясувалося, що 10-ти денний курс дає
кращі результати виліковування та покращення у випадках, коли в попередні місяці мав
місце епізод ГСО або у випадках з понад одним епізодом ГСО, істотної різниці у наслідках
між групами, які отримували 5-ти денний, 7-ми денний та 10-ти денний курс не
спостерігалося, ані між типами антибіотиків, ані за віком.
З іншого боку, метааналіз 7 РКД показав, що більш тривалий курс антибактеріальної терапії
давав кращий наслідок, ніж короткий у дітей до 2-х років, які відвідують дитячі дошкільні
заклади та мають перфорацію БП. Дітям старше 2-х років навіть з попереднім
антибактеріальним лікуванням рецидивуючого ГСО в анамнезі (Ovetchkine та співав., 2003,
Kozyrskyj та співав., 2000) рекомендований коротший курс. Клінічну ефективність курсу
антибактеріальної терапії менше 7-ми днів та довшого курсу (8– 19 днів) порівняно в іншому
метааналізі 32-х РКД. Було встановлено ефект п’ятиденної антибактеріальної терапії при
неускладненому ГСО. Leibovitz та співав. (2000) порівняв схему разового
внутрішньом’язового введення 50 мг/кг/день цефтриаксону з 3-денним курсом по 50
мг/кг/день цефтриаксону при ГСО, який не відповідає на лікування, та виявив що 3-денний
режим є істотно ефективнішим особливо при наявності частково чутливого до пеніциліну
S. Pneumonia та пеніцилін-резистентного
S.Pneumonia. Проте, внутрішньомязове введення
цефтриаксону у Японії не дозволено. Pichicero та співав. (2000) не знайшов суттєвої
відмінності у клінічній ефективності між 5-ти денним та 10-денним курсом цефуроксиму
аксетилу та зробив висновок, що короткий курс є ефективним завдяки кращому дотриманню
режиму прийому. Проте, у Японії цефуроксиму аксетил не є альтернативним лікуванням,
коли йдеться про етіологічні бактеріальні агенти. У мультицентровому сліпому (осліплення
лікарів) РКД Roos і співав. (2000) порівняли 5-ти денний та 10-денний курс цефтибутену по 9
мг/кг/день для лікування рецидивуючого ГСО та повідомили, що при 10-ти денному курсі
рівень рецидивів під час короткострокового наступного спостереження був нижчим. У
іншому проспективному дослідженні тривалості антибактеріальної терапії у хворих, котрі
раніше не отримували антибіотиків, був запропонований 5-ти денний курс лікування ГСО у
дітей старше 2-х років (Manarey та співав., 2002).
РКД, у якому порівнювали ефект 3-денного курсу амоксициліну (по 40 мг/кг) та плацебо за
допомогою анкети, не виявило значущої різниці у частоті рецидивів (Bezakova та співав.,
2009). Систематичний огляд, в якому було проаналізовано 35 РКД, що порівнювали ефекти
короткострокової (< 4 днів) та довгострокової (> 5 днів) терапії пероральним
антимікробними препаратами при ГСО у дітей показав, що ризик невдачі лікування зростав у
групі, яка отримувала коротким курсом короткодіючі антибіотики (Gulani та співав., 2010).
Дані результати свідчать про те, що слід рекомендувати щонайменше 4 дні прийому
антибіотиків, у разі необхідності.
В іншому РКД, в якому порівнювали ефективність 7-ми денного курсу
амоксициліну/клавуланової кислоти та плацебо при ГСО у дітей, було показано істотну
різницю у частоті невдач лікування починаючи з третього дня (Tahtinen та співав., 2011).
53
Hoberman та співав. (2011) також здійснив РКД, у якому порівнював ефекти 10-ти денного
курсу амоксициліну/клавуланової кислоти та плацебо при лікуванні ГСО у дітей. Вони
повідомили про істотну відмінність у частоті клінічних невдач починаючи з 4-го та 5-го днів
прийому. Дані результати можуть вказувати на те, що клінічна ефективність антибіотиків
з’являється щонайраніше на третій день прийому, а відтак рекомендується оцінювати
ефективність на третій день.
В новій настанові (США) щодо ГСО від 2013 року, дітям до 2-х років рекомендований 10-ти
денний курс антибіотиків у тяжких випадках, 7-ми денний курс при легкому та середньому
ступені тяжкості дітям 2– 5 років, та при середньому або легкому ступені тяжкості дітям
старше 6-ти років; та в настанові стверджується, що достатньо 5– 7 днів прийому. Також у
настановах США пропонується оцінювати ефект препарату на 2-й або 3-й день прийому у
випадках його першого використання (Lieberthal та співав., 2013).
Посилання
1. Ovetchkine P, Cohen R. Shortened course of antibacterial therapy for acute otitis media. Paediatr Drugs 2003; 5:133-
40.
2. Kozyrskyj AL, Hildes-Ripstein GE, Longstaffe SE, Wincott JL, Sitar DS, Klassen TP, Moffatt ME. Short course
antibiotics for acute otitis media. Cochrane Database Syst Rev 2000;CD001095.
3. Bezakova N,Damoiseaux RA、Hoes AW, Schilder AG, Rovers MM. Recurrence up to 3.5 years antibiotic treatment
of acute otitis media in very young Dutch children: survey of trial participants. BMJ 2009; 339:b2525
4. Gulani, A,Sachdev HP, Qazi SA. Efficacy of short course (<4 days) of antibiotics for treatment of acute otitis media
in children: a systematic review of randomized controlled trials. Indian pediatr 2010; 47,74-87.
5. Hoberman A, Paradise JL, Rockette HE, Shaikh N, Wald ER,Kearney DH, Colborn DK, Kurs-Lasky M, BhatnagarS,
Haralam MA, ZoffelLM, Jenkins C, Pope MA, Balentine TL, Barbadora KA. Treatment of Acute Otitis Media in
Children under 2 Years of Age. New Engl J Med 2011; Jan 13,105-115.
6. Tahtinen PA, Laine MK, Huovinen P, Ruuskanen O, RuoholaA. A Placebo- Controlled Trial of Antimicrobial
Treatment for Acute Otitis Media. The New England Journal of Medicine 2011; 13,116-126
7. Pichichero ME, Marsocci SM, Murphy ML, Hoeger W, Francis AB, Green JL. A prospective observational study of
5-, 7-, and 10-day antibiotic treatment for acute otitis media. Otolaryngol Head Neck Surg 2001; 124:381-7.
8. Leibovitz E, Piglansky L, Raiz S, Press J, Leiberman A, Dagan R. Bacteriologic and clinical efficacy of one day vs.
three day intramuscular ceftriaxone for treatment of nonresponsive acute otitis media in children. Pediatr Infect Dis J
2000; 19:1040-5.
9. Pichicero M. Short courses of antibiotic in acute otitis media and sinusitis infections. J Int Med Res 2000; 28 Suppl
1:25A-36A.
10. Roos K, Larsson P. Efficacy of ceftibuten in 5 versus 10 days treatment of recurrent acute otitis media in children.
Int J Pediatr Otorhinolaryngol 2000; 55:109-15.
11. Manarey CR, Westerberg BD, Marion SA. Clinical decision analysis in the treatment of acute otitis media in a child
over 2 years of age. J Otolaryngol 2002; 31:23-30.
12. Lieberthal AS, Carroll AE, Chonmaitree T, Ganiats TG, Hoberman A, Jackson MA, Joffe MD, Miller DT,
Rosenfeld RM, Sevilla XD, Schwartz RH, Thomas PA, Tunkel DE: The diagnosis and management of acute otitis
media. Pediatrics 2013; 131:e964-e99
Клінічне питання 21-9 Алгоритми лікування ГСО у дітей
Нижче наведено алгоритми лікування ГСО, створені шляхом поєднання результатів нашого
огляду доказів та думок експертів – членів підкомітету з розробки настанови. Дані алгоритми
рекомендовані для використання у неускладнених випадках ГСО. У клінічній практиці
лікувальну тактику слід обирати виходячи з конкретної ситуації кожного пацієнта. Якщо у
пацієнтів не спостерігається покращення ознак навіть після застосування препаратів третього
ряду з цієї настанови, ГСО слід вважати стійким. Такі випадки не розглядаються у даній
настанові.
54
Алгоритм лікування ГСО легкого ступеню тяжкості (1–5 балів)
Антибіотики не призначаються, вичікування три дні
Немає покращення
Покращення
Амоксіцилін 3 дні
Спостереження
Немає покращення
Покращення
Будь-який із 1-3 наведених
Амоксіцилін ще 2 дні
препаратів впродовж 3-х днів*
1. Висока доза амоксіциліну
2.
Ам
ок с
іц
и
лін у
к
ла
в
у
ла
н а
т Покращення
(1:14)
3. Цефдиторену півоксил
Спостереження
Немає покращення
Покращення
Той самий препарат ще 2
Перехід до будь-якого з 1-3 препаратів,
виходячи з чутливості, 5 днів*
дні
1. Висока доза амоксіциліну
2. Амоксіциліну клавуланат (1:14)
Покращення
3. Висока доза Цефдиторену півоксилу
Спостереження
Оталгія, гарячка (понад 38,5˚ С) – ацетамінофен по 10 мг/кг
Ознаки нежитю – лікування
Культуральне дослідження бактерій з носоглотки або виділень з вуха
Застосування
Lactobaccilus bifidus або
Miyarisan при прийомі антимікробних препаратів
*Розгляньте заміну антибіотика використовуючи швидкий тест для виявлення
S. Pneumonia Зверніть увагу на вторинну гіпокарнітинемію при призначенні антибіотиків, які містять
півоксил
Не перевищуйте наступні дози:
Амоксицилін: 500 мг/раз, 1500 мг/добу
Цефдиторену півоксил: 200 мг/раз, 600 мг/добу
Наступний огляд через три тижні від першого візиту
55
Алгоритм лікування ГСО середнього ступеню тяжкості (6– 11 балів)
Визначення тяжких змін при
Висока доза амоксициліну –
отоскопії –
3 днів
мирінготомія
Культуральне бактеріальне дослідження
Немає покращення Покращення
Висока доза амоксициліну
ще 2 дні
Будь-який з 1–3 препаратів на
підставі чутливості впродовж 3-х
Покращення
днів*
1. Амоксицилін/ клавуланова кислота
(1:14)
Спостереження
2. Висока доза Цефдиторену півоксилу
3. Мирінготомія + висока доза
амоксициліну
Немає покращення Покращення
Той самий препарат ще 2 дні
Будь-який з 1–4 препаратів впродовж 5-
ти днів*
Покращення
1. Мирінготомія + Амоксицилін/
клавуланова кислота (1:14)
2. Мирінготомія + Висока доза
Цефдиторену півоксилу
Спостереження
3. Тебіпенему півоксил**
4. Тосфлоксацин
Оталгія, гарячка (понад 38,5°С) – ацетамінофен по 10 мг/кг
Ознаки нежитю – лікування
Культуральне дослідження бактерій з носоглотки або виділень з вуха
Застосування
Lactobaccilus bifidus або
Miyarisan при прийомі антимікробних
препаратів
*Розгляньте заміну антибіотика використовуючи швидкий тест для виявлення
S. Pneumonia
Зверніть увагу на вторинну гіпокарнітінемію при призначенні антибіотиків, які
містять півоксил
**Максимум 7 днів відповідно до державної програми медичного страхування
Не перевищуйте наступні дози:
амоксицилін: 500 мг/раз, 1500 мг/добу
цефдиторену півоксил:200 мг/раз, 600 мг/добу
тебіпенему півоксил: 300 мг/раз, 600 мг/добу
тосфлоксацин: 180 мг/раз, 360 мг/добу
Наступний огляд через три тижні від першого візиту
56
Алгоритм лікування ГСО тяжкого ступеню тяжкості (понад 12 балів)
Мирінготомія + будь-який з 1–3 препаратів впродовж 3-х
днів*
(1) Висока доза амоксицикліну
(2) Амоксициклін/ клавуланова кислота (1:14)
(3) Висока доза Цефдиторену півоксилу
Немає покращення Покращення
Будь-який з 1–4 препаратів, залежно від чутливості,
Той самий препарат
впродовж 3-х днів*
ще 2 дні
(1) Мирінготомія + Амоксицилін/ клавуланова кислота
(1:14)
Покращення
(2) Мирінготомія + висока доза Цефдиторену півоксилу
(3) Тебіпенему півоксил**
(4) Тосфлоксацин
Спостереження
Немає покращення Покращення
Перший або другий впродовж 5-ти днів*
Той самий
(1) Мирінготомія +
Тебіпенему півоксил**
препарат ще 2 дні
(2) Мирінготомія + тосфлоксацин або внутрішньовенно
крапельно 1-й або 2-й впродовж 3-х днів
Покращення
(3) Ампіцилін по 150 мг/кг/день
(4) Цефтриаксон по 60 мг/кг (недоношеним
новонародженим та новонародженим <50 мг/кг/день)
Спостереження
Отальгія, гарячка (понад 38,5°С) – ацетамінофен по 10 мг/кг
Ознаки нежитю – лікування
Культуральне дослідження бактерій з носоглотки або виділень з вуха
Застосування
Lactobaccilus bifidus або
Miyarisan при прийомі антимікробних препаратів
*Розгляньте заміну антибіотика використовуючи швидкий тест для виявлення
S. Pneumonia
Зверніть увагу на вторинну гіпокарнітінемію при призначенні антибіотиків, які містять
півоксил
**Максимум 7 днів відповідно до державної програми медичного страхування
Не перевищуйте наступні дози:
амоксицилін: 500 мг/раз, 1500 мг/добу
цефдиторену півоксил:200 мг/раз, 600 мг/добу
тебіпенему півоксил: 300 мг/раз, 600 мг/добу
тосфлоксацин: 180 мг/раз, 360 мг/добу
Наступний огляд через три тижні від першого візиту
Коментар робочої групи: станом на 03 червня 2016 року препарати цефдиторену
півоксилу, тосфлоксацину, тебіпенему півоксилу в Україні не зареєстровані.
57
Робоча група схиляється до алгоритмів лікування, представлених в настанові «THE
DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA, 2013».
THE DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA, 2013
Загальне спостереження за пацієнтом з ГСО
Після покращення клінічного стану дитини подальші огляди проводяться відповідно до
клінічного перебігу ГСО. Необхідність рутинного огляду дитини через 10–14 днів після
одного випадку ГСО науково не підтверджена. Може проводитися повторний огляд дітей
молодшого віку з тяжкими симптомами, при рецидивуючому ГСО, а також на прохання
батьків дитини.
Тривала наявність секрету в середньому вусі зустрічається доволі часто і виявляється під час
пневматичної отоскопії (з подальшим проведенням тимпанометрії або без неї) після
зникнення гострих симптомів. У 60–70% дітей через два тижні після вдалого лікування ГСО
антибактеріальними препаратами відзначається присутність секрету в середньому вусі; через
1 місяць після лікування секрет в середньому вусі виявляється у 40% дітей, через 3 місяці – у
10–25%.177,195 Наявність ССВ без будь-яких клінічних ознак визначається як секреторний
середній отит (ССО). Слід клінічно відрізняти ССО від ГСО. При ССО антибактеріальні
препарати не призначають, але час від часу слід проводити додаткові огляди пацієнта.
Впевненість у тому, що ССО мине, має особливе значення для батьків дітей із затриманням
загального або когнітивного розвитку, оскільки тимчасове погіршення слуху внаслідок ССО
може мати негативні наслідки. Детальні рекомендації щодо тактики ведення дітей з ССО
можна знайти у науково обґрунтованій настанові AAP/AAFP/ Американської Академії
отоларингології – хірургії голови і шиї, опублікованому в 2004 році.84,85
Ключовий практичний висновок 5А
Лікар не повинен призначати антибіотики з профілактичною метою для зниження
частоти розвитку ГСО у дітей з рецидивуючим ГСО. (Рівень доказовості: В. Ступінь:
рекомендація)
Профіль ключового практичного висновку: КПВ 5А
Сукупний
рівень Ступінь В
доказововсті
Переваги
Відсутність небажаних явищ від прийому антибіотика. Зниження
вірогідності розвитку бактеріальної резистентності. Зниження
видатків.
Ризики, шкода,
Незначне зростання частоти епізодів ГСО.
вартість
Оцінка
Переважання користі.
співвідношення
користі/шкоди
Оціночні судження
Потенційна шкода вища за потенційну користь.
Навмисна
Відсутня.
невизначеність
Роль побажань
Обмежена.
пацієнтів
Виключення
Діти молодшого віку, єдиною альтернативою для яких є введення
тимпаностомних вентиляційних шунтів.
Ступінь
Рекомендація
58
Ключовий практичний висновок 5B
За умови частих рецидивів ГСО (3 випадки за 6 місяців або 4 випадки на рік з 1
проявом за попередні 6 місяців) лікар може виконати тимпаностомію з введенням
вентиляційного шунта. (Рівень доказовості: В. Ступінь: варіант вибору)
Профіль ключового практичного висновку: КПВ 5B
Сукупний рівень доказовості
Ступінь В
Переваги
Зменшення частоти випадків ГСО. Можливість
місцевого лікування ГСО антибактеріальними
препаратами.
Ризики, шкода, вартість
Ризик необхідності застосування анестезії або
проведення хірургічного втручання. Вартість.
Рубцювання БП, хронічна перфорація, холестеатома.
Оторея.
Оцінка співвідношення
Баланс співвідношення шкоди/користі.
користі/шкоди
Оціночні судження
Відсутні.
Навмисна невизначеність
Вибір заснований на обмежених доказах.
Роль побажань пацієнтів
Спільне рішення пацієнта і лікаря.
Виключення
Будь-які протипоказання до анестезії та проведення
хірургічних втручань.
Ступінь
Варіант вибору
Призначення цього розділу
Рецидивуючий ГСО діагностується за появи 3 чи більше епізодів ГСО протягом 6-ти місяців,
або ж 4 чи більше епізодів ГСО протягом року, включно з епізодом впродовж останніх 6-ти
місяців.20 Про кожен з епізодів ГСО і гострих інфекційних захворювань слід зробити
вичерпний запис.11
До частих рецидивів ГСО можуть призводити такі фактори, як зимовий період, чоловіча
стать і пасивне куріння. У половини дітей віком до 2-х років, які лікувалися від ГСО,
повторний епізод хвороби спостерігається протягом 6-ти місяців. Симптоми, які тривають
більше за 10 днів, також можуть свідчити про рецидивуючий характер захворювання у
майбутньому.196
Відмінності від настанови щодо ГСО ААР/AAFP 2004 року
У клінічній настанові з лікування ГСО за 2004 рік відсутні вказівки щодо лікування
рецидивуючого ГСО. У цьому розділі подано огляд літератури з питання рецидивуючого
ГСО.
Профілактична антибактеріальна терапія
З метою попередження розвитку подальших епізодів у дітей з рецидивуючим ГСО
використовується довгострокова антибактеріальна терапія у малих дозах, також відома як
хіміопрофілактика.85 Аналіз результатів 16-ти досліджень довгострокової антибактеріальної
терапії ГСО, зроблений в огляді Кокранівської бази даних за 2006 рік, свідчить про
зменшення частоти виникнення епізодів на 1,5 епізоди на рік і зменшення загальної кількості
епізодів вдвічі протягом всього терміну лікування.197 Результати РКД хіміопрофілактики
свідчать про зниження частоти епізодів ГСО на 0,09 випадків на місяць внаслідок цього виду
терапії (приблизно на 0,5–1,5 епізодів на рік у 95% дітей). Для запобігання 1 епізоду СО слід
59
лікувати приблизно 5 дітей протягом 1 року. У дітей із >6 епізодами ГСО на рік ефект від
хіміопрофілактики може бути краще вираженим.12
Зменшення кількості епізодів ГСО спостерігалося лише під час профілактичного прийому
антибактеріального препарату. Помірна користь від піврічного курсу профілактичного
лікування не носить довготривалого характеру після закінчення прийому препарату.
Дослідження Teele не показали відмінностей між групою дітей, які отримували
профілактичне антибактеріальне лікування з приводу рецидивуючого ГСО або стійкого
ССО, і групою дітей, які отримували плацебо.198
Дітям, у яких протягом тривалого часу виявляється секрет в середньому вусі, або дітям з
нечастими епізодами ГСО хіміопрофілактику не призначають. Незначне зниження частоти
виникнення ГСО під час довготривалої хіміопрофілактики слід співвіднести з вартістю
лікування, потенційним виникненням небажаних явищ внаслідок прийому антибіотиків,
зокрема алергічних реакцій та розладів шлунково-кишкового тракту, а також із розвитком
бактеріальної резистентності.
Хірургічне втручання при рецидивуючому ГСО
Єдиної точки зору на використання тимпаностомних вентиляційних шунтів у лікуванні
захворювань вуха, зокрема ГСО, не існує.199 У більшості опублікованих досліджень
хірургічних втручань при СО йдеться про дітей зі стійкою наявністю ССВ, що
супроводжується або не супроводжується ГСО. У науковій літературі майже не
зустрічаються випадки хірургічного втручання при рецидивуючому ГСО згідно описаних
вище критеріїв. Про відсутність спільної точки зору лікарів-отоларингологів щодо значення
хірургічного втручання при рецидивуючому ГСО свідчить і опитування, проведене серед
канадських спеціалістів: 40% опитуваних відповіли, що «ніколи» не рекомендують
встановлення тимпаностомних шунтів дворічним дітям із частими випадками СО без
постійної присутності ССВ або погіршення слуху; 30% відповіли «інколи рекомендують», і
ще 30% відповіли «часто або завжди рекомендують».200
Втім, встановлення тимпаностомних шунтів отримало широке розповсюдження в клінічній
практиці як при ССО, так і при рецидивуючому СО.201 При рецидивуючому ГСО
рекомендований огляд лікаря-отоларинголога.
У трьох РКД порівнювалася кількість епізодів ГСО після встановлення тимпаностомних
шунтів та кількість епізодів у пацієнтів без хірургічного втручання.202 Результати двох
досліджень свідчать про значне зменшення середньої кількості епізодів ГСО протягом
піврічного періоду спостереження після встановлення тимпаностомних шунтів.203,204 Під час
одного з досліджень дітей з рецидивуючим ГСО було рандомізовано у три групи: прийому
плацебо,
хіміопрофілактики
із
застосуванням
амоксициліну
та
встановлення
тимпаностомних шунтів. Спостереження за групами тривало 2 роки.205 В групі
хіміопрофілактики частота випадків ГСО знизилася; різниці у кількості епізодів ГСО в
групах плацебо і хірургічного втручання впродовж дворічного спостережного періоду не
спостерігалося. Огляд досліджень Кокранівської бази, які вивчали ефективність
тимпаностомії при рецидивуючому ГСО, виявив 2 дослідження,204,206 під час яких було
дотримано критеріїв включення пацієнтів. Результати досліджень свідчать про зменшення
кількості епізодів ГСО на 1,5 епізоди протягом 6 місяців після операції.207 Доведено, що
встановлення тимпаностомних шунтів сприяє зменшенню дискомфорту, пов’язаного із
СО.208 Результати мультицентрового, нерандомізованого обсерваційного дослідження
свідчать про значне зменшення дискомфорту, пов’язаного із захворюванням, і покращення
якості життя; вимірювання проводилося шляхом оцінки фізичного стану, психологічного
стресу, втрати слуху, розладів мовлення, обмеження руху, занепокоєння батьків дитини з
приводу вушної інфекції.209 Переваги встановлення тимпаностомних шунтів відзначалися у
змішаних популяціях дітей, у тому числі у дітей з ССО та рецидивуючим ГСО.
При встановленні тимпаностомних шунтів, окрім вартості процедури, слід зважити на
незначні ризики, пов’язані із анестезією та хірургічним втручанням. Останній огляд
60
протоколів, проведений з метою мінімізувати ризики при оперативному втручанні, свідчить
про відсутність тяжких ускладнень, таких як нейросенсорна втрата слуху, розрив судин або
травми слухових кісточок у 10 000 випадків встановлення трубок лікарями-резидентами.
Втім у 0,016% випадків спостерігалися ускладнення легкого ступеню, такі як випіт у
барабанній порожнині або зміщення трубки в барабанну порожнину.210 До довготривалих
ускладнень після встановлення трубок відносять структурні зміни в БП, в тому числі
вогнищеву атрофію, тимпаносклероз, утворення ретракційних кишень та стійку перфорацію.
За результатами метааналізу, тимпаносклероз спостерігався у 32% пацієнтів після
встановлення трубок, стійка перфорація – у 2,2% пацієнтів із трубкою, встановленою на
короткий термін, і у 16,6% пацієнтів із трубкою, встановленою на довготривалий строк.211
Видалення аденоїдів без проведення міринготомії та/або встановлення тимпаностомних
шунтів не сприяє зменшенню частоти епізодів ГСО у порівнянні з хіміопрофілактикою або
прийомом плацебо.212 Аденоїдектомія може не запобігти рецидивам. Втім, видалення
аденоїдів може бути доцільним при подальшому встановленні тимпаностомних шунтів або у
дітей з ССО, яким вже встановлено такі шунти.213
Профілактика ГСО: Ключовий практичний висновок 6А
Пневмококова вакцина
Клініцисти повинні рекомендувати пневмококову кон’юговану вакцину усім дітям
відповідно до графіка Консультативного комітету з імунізації (
Рівень доказовості: В.
Ступінь: наполеглива рекомендація) Профіль ключового практичного висновку: КПВ 6А
Сукупний
рівень Ступінь В
доказовості
Переваги
Зменшення частоти випадків ГСО, що викликається тим самим
серотипом збудників, що присутній у вакцині. Зменшення ризику
розвитку серйозної системної пневмококової інфекції.
Ризики, шкода,
Потенційні побічні ефекти після щеплення. Вартість вакцини.
вартість
Оцінка
Переважання користі.
співвідношення
шкоди/користі
Оціночні судження
Потенційні небажані явища після щеплення незначні.
Навмисна
Відсутня.
невизначеність
Роль побажань
Деякі пацієнти можуть відмовитись від щеплення.
пацієнтів
Виключення
Важкі алергічні реакції (анафілактичний шок) на будь-який з
компонентів антипневмококової вакцини або дифтерійної вакцини
із вмістом дифтерійного анатоксину.
Ступінь
Наполеглива рекомендація
Ключовий практичний висновок 6B
Щеплення проти грипу: Всім дітям лікар може рекомендувати проводити щорічне
щеплення проти грипу. (Рівень доказовості: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 6B
Сукупний
рівень Ступінь В
61
доказовості
Переваги
Зменшення ризику інфекції грипу. Зменшення частоти розвитку
ГСО, пов’язаного із грипом.
Ризики, шкода,
Потенційні небажані явища після щеплення. Вимагається щорічна
вартість
імунізація.
Оцінка
Переважання користі.
співвідношення
шкоди/користі
Оціночні судження
Потенційні небажані явища після щеплення незначні.
Навмисна
Відсутня.
невизначеність
Роль побажань
Деякі пацієнти можуть відмовитись від щеплення.
пацієнтів
Виключення
Див. вказівки Центру контролю і профілактики захворювань
(http://www.cdc.gov/flu/ professionals/acip/shouldnot.htm)
Ступінь
Рекомендація
Ключовий практичний висновок 6C
Грудне вигодовування: практикуючі лікарі повинні рекомендувати виключно грудне
вигодовування щонайменш впродовж перших 6 місяців життя дитини (Рівень
доказовості: В. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 6C
Сукупний рівень доказовості
Ступінь В
Переваги
Можливе зниження ризику розвитку ГСО у ранньому віці.
Окрім цього, грудне вигодовування має інші численні
переваги, не пов’язані із профілактикою ГСО.
Ризики, шкода, вартість
Немає.
Оцінка співвідношення
Переважання користі.
користі/шкоди
Оціночні судження
Має переваги, не пов’язані з профілактикою ГСО.
Навмисна невизначеність
Немає.
Роль побажань пацієнтів
Деякі батьки надають перевагу сумішам для дитячого
харчування.
Виключення
Немає.
Ступінь
Рекомендація
Ключовий практичний висновок 6D
Практикуючі лікарі повинні рекомендувати відмову від тютюнопаління (Рівень
доказовості: С. Ступінь: рекомендація)
Профіль ключового практичного висновку: КПВ 6D
Сукупний рівень доказовості
Ступінь С
Переваги
Можливе зниження ризику розвитку ГСО.
62
Ризики, шкода, вартість
Немає.
Оцінка співвідношення
Переважання користі.
користі/шкоди
Оціночні судження
Відмова від тютюнопаління має переваги, не пов’язані із
профілактикою ГСО.
Навмисна невизначеність
Немає.
Роль побажань пацієнтів
Деякі батьки не бажають припиняти палити, для інших
позбутися залежності від тютюнопаління неможливо.
Виключення
Немає.
Ступінь
Рекомендація
Мета цього розділу
У рекомендаціях щодо діагностики і лікування ГСО, розроблених у 2004 році, наведено
інформацію щодо ролі вакцинації, грудного вигодовування та способу життя у зниженні
ризику розвитку ГСО. У цьому розділі запропоновано дані, опубліковані після 2004 року.
Зміни до настанови AAP/AAFP з лікування ГСО 2004 року
7-валентна
кон’югована
вакцина
для
профілактики
пневмококових
інфекцій
використовується у США з 2000 року. 13-валентна кон’югована вакцина ліцензована у США
з 2010 року. З метою профілактики захворювань, викликаних S pneumoniae та нетипова ними
штамами H infuenzae, у Європі нещодавно було ліцензовано 10-валентну пневмококову
вакцину кон’юговану з D-протеїном. У США на сьогодні щорічна вакцинація проти грипу
рекомендована для всіх дітей віком від 6 місяців.214,215 Сьогодні вивчають оновлена
інформація щодо застосування цих вакцин та їх впливу на захворюваність ГСО.
У лютому 2012 року AAP опублікувала нові рекомендації щодо грудного вигодовування.216
Ці рекомендації також включають застереження щодо впливу паління. Окрім цього,
розглянуто ризики недбалого поводження із дитячою пляшечкою, соскою, особливості
догляду за дитиною, проте чіткіші рекомендації не запропоновано через обмежену кількість
доказової бази. Використання ксиліту як можливого додаткового засобу при профілактиці
ГСО також обговорюють, однак жодних рекомендацій не наведено.
Коментар робочої групи: робоча група також акцентує увагу на тому, що при
виборі тактики профілактики ГСО слід враховувати наявність факторів ризику
Фактори ризику виникнення гострого середнього отиту у дітей (Косаковський А.Л. Лікування
болю – пріоритетне завдання в терапії неускладненого гострого середнього отиту у дітей// Современная
педиатрия. – 2015, – № 3. – С.39-44)
Фактор
Коментар
Вік
Здебільшого ГСО виникає у дітей від 6 до 24 місяців, у
цьому віці слухова труба коротша та розташована
під меншим кутом. Фізіологічні та імунологічні
реакції на інфекції у дітей слабо розвинені
Відсутність
грудного Грудне вигодовування протягом щонайменше трьох
вигодовування
місяців має захисний ефект; це може бути пов’язано з
позицією, яка підтримується під час грудного
вигодовування, рухами немовляти та захисними
факторами, які є в грудному молоці
Денний
догляд
у
великих Численні контакти з дітьми протягом дня
группах*
полегшують поширення бактеріальних і вірусних
63
патогенів
Етнічна група*
Підвищений ризик серед дітей корінних американців,
канадських ескімосів на Алясці
Вплив сигаретного диму
Ризик підвищується при впливі сигаретного диму та
забрудненні повітря, особливо якщо батьки палять
Чоловіча стать
Трохи більша частота поширеності
Більше одного брата/сестри, які Підвищений ризик невдалого лікування антибіотиками
мешкають разом*
Використання дитячої соски
Збільшення частоти поширеності
Попереднє
застосування Підвищений ризик невдалого лікування антибіотиками
антибіотиків*
Перенесений отит середнього Підвищений ризик невдалого лікування антибіотиками
вуха*
Пора року*
Збільшення рівня поширеності восени і взимку
Супутня патологія*
Збільшення захворюваності у дітей з алергічним
ринітом, вовчою пащею, синдромом Дауна
Примітка. *Фактори, які також збільшують ризик рецидивного гострого середнього
отиту.
THE DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA, 2013
Вакцина проти пневмококових інфекцій
Використання антипневмококових кон’югованих вакцин є ефективним методом для
запобігання середнього отиту, викликаного серотипами збудника, які охоплює вакцина.
Метааналіз 5 досліджень за участю хворих на ГСО виявив, що захворюваність на ГСО,
викликаний усіма пневмококовими серотипами, була нижчою серед дітей, які отримали 7-
валентну пневмококову кон’юговану вакцину у віці до 24 місяців.217 Хоча загальна користь,
виявлена в ході клінічних досліджень ГСО різної етіології, є незначною (6–7%),218–221
обсерваційні дослідження показали, що частота відвідування лікаря зі скаргами на отит була
знижена на 40% після впровадження 7-валентної пневмококової кон’югованої вакцини.222–224
Попри це, як повідомлено у дослідженні Grijvala,223 при вакцинації дітей старшого віку
жодного ефекту не виявлено. У звітах Poehling та співав.225 повідомляють про зниження
захворюваності на отит і частоти використання тимпаностомічних шунтів після
впровадження 7-валентної пневмококової кон’югованої вакцини. Дещо більша користь у
загальної популяції населення, ніж у клінічних дослідженнях, є не до кінця з’ясованою і
може бути пов’язана з ефектом популяційного імунітету або довготривалими тенденціями чи
змінами у діагностичних критеріях ГСО.223;226–229 У Кокранівському огляді за 2009 рік.221
Jansen та співав. виявили, що частота первинної захворюваності на ГСО може знизитися
всього лише на 6–7%, але навіть таке незначне зниження може мати суттєве значення для
охорони громадського здоров’я. O’Brien та співав. погоджуються з цим твердженням і
зазначають, що таке зниження захворюваності позитивно впливає і на скорочення витрат на
медичне обслуговування.230 Існують докази того, що заміна серотипів може знизити
довгострокову ефективність антипневмококових кон’югованих вакцин проти ГСО,231 але
цілком імовірно, що нові антипневмококові кон’юговані вакцини можуть бути ефективніші
для зниження захворюваності на ГСО.232–234 Даних про зниження захворюваності на ГСО
внаслідок впровадження 13-валентної кон’югованої вакцини у США у 2010 році ще немає.
64
Вакцина гемофільної палички, кон’югована з D-протеїном, яка нещодавно була ліцензована
у Європі, має потенційну ефективність проти 10 серотипів
S. pneumoniae і нетипованих
штамів
H. Influenza.221; 234
Вакцина проти грипу
У більшості випадків ГСО виникає як наслідок інфекцій верхніх дихальних шляхів,
спричинених вірусами, зокрема, вірусами грипу. Дві третини дітей молодшого віку, які
хворіють на грип, можуть мати ГСО.235 Дослідниками вивчено ефективність застосування
тривалентної інактивованої протигрипозної вакцини (ТІВ) і живої атенуйованої
інтраназальної вакцини проти грипу (ЖАІВПГ) для профілактики ГСО. Багатьма
дослідженнями доведено підвищення на 30–55% ефективності застосування вакцини проти
грипу у профілактиці ГСО в період сезонної активності респіраторних захворювань.6; 235–239 В
одному із досліджень йдеться про неефективність застосування ТІВ для профілактики ГСО,
проте впродовж одного із двох сезонів респіраторних захворювань, під час яких
виконувалося дослідження, активність грипу була відносно низькою. Об’єднаний аналіз240
8 досліджень продемонстрував, що застосування ЖАІВПГ є ефективнішим у порівнянні з
плацебо і ТІВ.241–248 На сьогодні у США щорічна вакцинація проти грипу рекомендована для
всіх дітей віком від 6 місяців.214; 215
Грудне вигодовування
Численні дослідження доводять, що грудне вигодовування впродовж перших 4–6 місяців
знижує кількість випадків захворювання на ГСО та кількість його рецидивів.249–253 Два
когортні дослідження (1 ретроспективне250 й 1 проспективне253 дослідження) показали, що
частково чи виключно грудне вигодовування впродовж перших 6 місяців життя демонструє
дозозалежний ефект. У ході мультиваріантного аналізу встановлено, що ризик
нерецидивуючого отиту становив 0,61 (95% довірчий інтервал (ДІ): 0,4–0,92) при порівнянні
виключно грудного вигодовування протягом 6 місяців із його відсутністю або грудним
вигодовуванням менше 4 місяців. У ході проспективного когортного дослідження Scariatti253
також виявлено дозозалежний ефект грудного вигодовування. У цьому дослідженні про
випадки захворювання на середній отит повідомляли батьки. В систематичному огляді
McNiel та співав.254 виявлено, що у випадку, якщо грудне вигодовування є регулярним, то
перераховане співвідношення шансів (СШ) демонструє наявність ризику при штучному
годуванні незалежно від виду суміші. Наприклад, використання будь-якої суміші для
харчування впродовж перших 6 місяців тісно пов’язане із підвищеним ризиком виникнення
середнього отиту (СШ: 1,78 95% ДІ: 1,19–2,70; СШ: 4,55; 95% ДІ 1,64–12,50 у доступних
дослідженнях, узагальнене СШ для будь-якої харчової суміші впродовж перших 3-х місяців:
2,00; 95% ДІ: 1,40–2,78). У багатьох дослідженнях255–259 доведено взаємозв’язок між ГСО та
іншими інфекційними захворюваннями дітей молодшого віку та тривалістю грудного
вигодовування, проте у всіх цих дослідженнях були обмеження та жодне з них не було РКД.
Попри це, усі ці дослідження засвідчують захисний ефект виключно грудного
вигодовування. У всіх дослідженнях здебільшого взяли участь пацієнти білої раси, а
відвідування дитячого садка та вплив тютюнопаління не були контрольовані. Про спосіб
вигодовування повідомляли батьки. Те, що результати усіх цих досліджень були однаковими
щодо зниження захворюваності на ГСО та рецидивуючий отит при грудному годуванні,
підтверджує рекомендації AAP щодо користі виключно грудного вигодовування впродовж
перших 6 місяців та продовження вигодовування грудьми протягом щонайменше першого
року життя, поки є спільне бажання матері та дитини.216
Зміни способу життя
Окрім багатьох інших переваг260 уникнення впливу тютюнового диму, існує припущення, що
це впливає і на зниження захворюваності на ГСО у дітей молодшого віку252,261–264.
Використання пляшечок та сосок також пов’язане із виникненням ГСО.
65
Відмова від вигодовування дитини в лежачому положенні і припинення/обмеження
використання соски впродовж наступних 6 місяців життя дитини може знизити
захворюваність на ГСО.265–267 В нещодавньому когортному дослідженні було показано, що
використання сосок було асоційовано з рекурентними ГСО.268
Зниження частоти захворюваності на інфекції верхніх дихальних шляхів впродовж віку
немовляти та раннього дитинства шляхом оптимізації схеми перебування у дитячому
колективі може суттєво скоротити захворюваність на ГСО.249,269
Ксиліт
Ксиліт або березовий цукор є п’ятивуглецевим цукровим спиртом. Він входить до складу
жувальних гумок, сиропів, льодяників. У Кокранівському огляді за 2011 рік270 досліджено
роль ксиліту для запобігання рецидивуючого ГСО. У чотирьох дослідженнях виявлено
статистично значуще зниження на 25% ризику виникнення ГСО серед здорових дітей, які
увійшли в групу з використанням ксиліту, у порівнянні з контрольною групою (ВР: 0,75;
95% ДІ: 0,65 до 0,88; відмінності різниця показників -0,07; 95% ДІ: -0,12 до -0,03).271–274
Жувальні гумки та льодяники зі вмістом ксиліту виявилися ефективнішими, ніж сироп. Для
дітей віком до 2-х років, які найбільше підпадають під ризик виникнення ГСО, вживати
жувальні гумки і льодяники небезпечно. Окрім цього, для того щоб отримати захисний
ефект, ксиліт потрібно вживати 3–5 разів на день. Він неефективний для лікування ГСО і
його слід приймати впродовж всього періоду загострення респіраторних захворювань.
Епізодичне використання чи використання за потреби є неефективним.
Перспективи подальших досліджень
Незважаючи на успіхи існуючих досліджень, які частково пов’язані із розробкою
рекомендацій щодо діагностики та лікування ГСО 2004 року, досі залишається багато
нез’ясованих питань у цьому напрямку. Нижче описано клінічні проблеми, які досі
потребують розв’язання.
Діагностика
Імовірно, стандартний метод діагностики ГСО розробити неможливо через широкий
діапазон симптоматики секреторного середнього отиту і ГСО. Новітні технології дозволяють
за допомогою невеликої кількості рідини, отриманої в ході тимпаноцентезу, виявити на
додачу до бактерій чи вірусів маркери запалення. Проте проведення тимпаноцентезу у дітей
з неускладненим отитом не виконують через етичні та інші причини.
Методи, які допомагають точніше виявити наявність ССВ і випинання БП, є простішими у
використанні, ніж тимпанометрія, і тому їх застосування більш бажане, особливо у дітей, які
важко піддаються обстеженню. Важливою перспективою досліджень є розробка недорогого,
простого у використанні пневматичного відеоотоскопа.
Початкова терапія
Нещодавні дослідження, виконані Hoberman31 та Tähtinen,32 стосувалися оцінки зовнішнього
вигляду БП на основі строгих діагностичних критеріїв ГСО. Проте результати досліджень із
менш строгими діагностичними критеріями (комбінація симптомів, секрет середнього вуха і
зовнішній вигляд БП) не завжди відповідають ССО і можуть бути прогнозовані із попередніх
досліджень, у яких використовувалися менш строгі критерії. РКД, сфокусовані на
зовнішньому вигляді БП, використовують шкалу, схожу на OS-8 (отоскопічну шкалу)35, і
підтверджують переваги використання початкової антибіотикотерапії і первинного
спостереження. Наступні дослідження повинні також охоплювати тяжкість симптомів
захворювання, одно-/двобічність ураження, наявність отореї.
Також повинні бути розроблені кінцеві точки лікування. Зокрема, варто з’ясувати, чи є
зовнішній вигляд БП у пацієнтів без клінічних симптомів в кінці дослідження суттєвими для
повторного виникнення захворювання чи персистуючої форми хвороби. Такі дослідження
66
вимагають рандомізації пацієнтів, стан БП яких не покращується, щоб продовжувати прийом
антибіотиків та спостереження.
Необхідно вивчати найбільш ефективні та прийнятні методи спостереження, щоб оцінити
співвідношення переваг та потенційних ризиків лікування.
Антибіотики
Амоксицилін-клавуланат має ширший спектр застосування, ніж амоксицилін, і може бути
ефективнішим препаратом для початкової антибіотикотерапії. Попри це, через високу
вартість та побічну дію препарату нами було обрано амоксицилін як препарат першої лінії
для лікування ГСО. РКД, які б порівняли обидва препарати з точки зору їх клінічної
ефективності, прояснять їх доцільність. Чіткі діагностичні критерії повинні бути стандартом
таких досліджень. Порівняння антибіотиків, призначених для лікування ГСО, повинні
включати групу пацієнтів із нетяжкими симптомами захворюванням, щоб переконатися у
наявності терапевтичного ефекту у порівнянні з плацебо. Також дослідження повинні
охоплювати достатню кількість пацієнтів, щоб продемонструвати невелику, але суттєву
різницю ефективності.
Дослідження щодо імовірності резистентних штамів
S. pneumoniae та
H. influenzae у дітей,
що відвідують дитячі колективи та які мають братів/сестер, молодших 5 років, уже існують.
Попри це, досі не здійснено досліджень, які б встановили, чи ці та інші фактори ризику
означають потребу в зміні звичайної початкової терапії.
Через розвиток мультирезистентних організмів існує необхідність розробки нових
антибіотиків, які були б безпечними та ефективними при ГСО.
Також необхідні РКД щодо тривалості лікування антибіотиками у різних вікових групах,
щоб оптимізувати терапію і знизити тривалість використання антибіотиків. Це слід
здійснювати з використанням амоксициліну та амоксицилін-клавуланату, а також інших
антибіотиків, які використовуються при ГСО. Знову ж таки, у дослідження слід включити
групу пацієнтів з нетяжкими симптомами захворювання.
Рецидивуючий ГСО
На сьогодні існує багато досліджень щодо використання антибіотиків у профілактичних
цілях при рецидивуючому ГСО. Необхідною є більша кількість контрольованих досліджень
ефективності та доцільності тимпаностомії, які допоможуть встановити співвідношення
користі та шкоди.
Профілактика
На сьогодні існує необхідність розробки вакцин, спрямованих на найбільш типові збудники
ГСО.275 Цілеспрямовані епідеміологічні дослідження щодо переваг грудного вигодовування,
особливо з точки зору запобігання ГСО, включаючи роль тривалості вигодовування та
порівняння частково та виключно грудного вигодовування, допоможуть конкретизувати ті
дані, які на сьогодні є лише загальними. Імовірно, що дослідження впливу способу життя на
виникнення ГСО допоможуть встановити їх взаємозв’язок.
Додаткові та альтернативні лікарські засоби
Немає добре спланованих РКД щодо користі додаткових і альтернативних лікарських засобів
при ГСО, хоча багато сімей звертаються до цих методів. Хоча більшість методів
альтернативної медицини відносно дешеві, деякі можуть бути дорогими. Такі дослідження
повинні порівнювати альтернативні лікарські засоби з групою спостереження, а не з групою
антибіотикотерапії; порівняння з групою антибіотикотерапії слід проводити тільки тоді, коли
результати групи альтернативних медтодів лікування виявилися кращими від результатів
групи спостереження. Такі дослідження мали б зосередитися на дітях з менш строгими
критеріями ГСО, але застосовувати такі ж описові критерії для пацієнтів, що було вказано
вище.
67
ВПРОВАДЖЕННЯ НАСТАНОВИ
Звіт Інституту медицини зазначає, що «Ефективні багатовекторні стратегії впровадження
рекомендацій, спрямовані і на окремих людей, і на систему охорони здоров’я, повинні
запроваджуватися з метою підвищення надійності лікування [клінічні практичні
настанови]».230
На сьогодні є багато досліджень щодо впливу рекомендацій на клінічну практику. Загалом,
дослідження свідчать, що на практиці відбулася невелика кількість змін з часу публікації
рекомендацій. Проте, як було помічено після їх публікації у 2004 році, кількість візитів до
лікарів із скаргами на це захворювання та кількість призначених антибіотиків знизилася. Ось
чому є необхідність розробки методів інформування та розповсюдження рекомендацій на
рівні практикуючих лікарів та інтернів.
Коментар робочої групи: робоча група вважає за потрібне доповнити Адаптовану
клінічну настанову інформацією для пацієнта з гострим середнім отитом (Косаковський А. Л.
Інформація для пацієнта з гострим середнім отитом [Електронний ресурс]/ А. Л. Косаковський,
Ф. Б. Юрочко// Медицина світу. –2016. –Квітень. –Режим доступу: http://msvitu.com/archive/2016/april/article-
4.php (Дата звернення: 31.05.2016). – Назва з екрана), що стане необхідним інструментом в роботі
лікарів первинної медичної допомоги, та алгоритмами ведення пацієнта з ГСО.
Інформація для пацієнта з гострим середнім отитом
Гострий середній отит
Гострий середній отит належить до найчастіших бактеріальних хвороб дитячого віку.
Немало випадків отиту може минути без лікування антибіотиками. Наявні методи
діагностики та лікування здатні допомогти таким пацієнтам. В певних випадках
призначають антибіотики. Ускладнення трапляються рідко і до них належать випадки
переходу запального процесу на структури вискової кістки чи в порожнину черепа.
Які анатомічні ділянки має вухо?
Вухо розміщене у висковій кістці. Анатомічно вухо поділяють на 3 ділянки – зовнішнє вухо,
середнє вуха та внутрішнє вухо. До зовнішнього вуха належать вушна раковина та
зовнішній слуховий хід. До середнього вуха належать барабанна порожнина, слухова труба
та клітини соскоподібного відростка. Межею між зовнішнім і середнім вухом є барабанна
перетинка. До внутрішнього вуха належать система півколових каналів (належать до
органу рівноваги), слимак (належить до органу слуху).
Що таке отит?
Отит – запалення вуха. За анатомічною локалізацією розрізняють зовнішній отит
(запалення зовнішнього вуха), середній отит (запалення середнього вуха, передусім
барабанної порожнини). Запалення внутрішнього вуха може бути в півколових каналах
(лабіринтит) чи слимаку (кохлеїт).
В дітей найчастіше трапляється середній отит. При тривалості запалення до 3 тижнів
середній отит вважають гострим.
Причини гострого середнього отиту
Причиною середнього отиту є інфекція (вірусна, бактеріальна чи вірусно-бактеріальна).
Інфекція потрапляє в більшості випадків у барабанну порожнину через слухову трубу,
набагато рідше внаслідок травми (наприклад, розрив барабанної перетинки) чи
гематогенно (через кров).
Які фактори ризику розвитку гострого середнього отиту
Факторами ризику гострого середнього отиту є наступні: малий вік пацієнта (до 2 років),
відсутність грудного вигодовування, перебування в дитячих колективах протягом дня
(зокрема, в дитсадках), тривалий вплив тютюнового диму (пасивне паління), чоловіча
стать, зригування в немовлят, холодна пора року (осінь і зима), раніше перенесений середній
68
отит, супутня патологія (наприклад, алергічний риніт, синдром Дауна, розщелина
піднебіння).
Які симптоми гострого середнього отиту?
Найчастішими специфічними симптомами є біль вуха, зниження слуху, гноєтеча з вуха.
Також трапляються загальні симптоми – підвищена температура тіла, слабість,
млявість, неспокійний сон, безсоння, знижений апетит, дратівливість, плач.
Діагностика гострого середнього отиту
Лікар може діагностувати гострий середній отит на підставі наявних у Вас скарг та
виявлення характерних ознак при огляді. Для діагностики лікар повинен виконати отоскопію
(огляд вуха з обов’язковим оглядом слухового ходу та барабанної перетинки), також він
оглядає порожнину носа, рота та глотки. Іноді є потреба виконати додаткові обстеження
(аналіз крові, обстеження слуху, тимпанометрію). При підозрі на ускладнення лікар
скеровує на комп’ютерну томографію чи магнітно-резонансну томографію.
Чи потрібні антибактеріальні лікарські засоби для лікування гострого середнього
отиту?
Гострий середній отит може минути самостійно, без призначення антибіотиків. У певних
випадках лікар може обрати тактику уважного спостереження, яка полягає у призначенні
симптоматичного лікування (знеболення та краплі до вуха). В інших випадках лікар
призначає антибіотик і симптоматичне лікування. При супутньому риносинуситі лікар
також може призначити відповідне лікування.
Яке симптоматичне лікування гострого середнього отиту?
Деякі види лікування можуть полегшити Ваш стан. До них належать
Такі болезаспокійливі засоби, як парацетамол або ібупрофен, як правило, полегшують біль.
Вони також можуть нормалізувати підвищену температуру тіла.
Краплі до вуха – зменшують біль, запалення, зменшують гноєтечу
Для забезпечення ефекту і безпеки фармакотерапії треба дотримуватись рекомендацій із
застосування лікарських засобів, призначених лікарем, та інструкції для медичного
застосування препаратів. До завершення курсу лікування слід зберігати упаковку
лікарського засобу, на якій зазначені назва, форма випуску, доза, серія, дата випуску, термін
придатності, назва виробника лікарського засобу.
Які небезпечні симптоми, які потребують невідкладної консультації лікаря?
Увага! Обов’язково звертайтеся до свого лікаря у випадку, якщо Ваш стан не покращується
(або погіршується) впродовж 2-3 діб від початку захворювання/лікування.
Симптоми, про наявність яких потрібно повідомити невідкладно Вашого лікаря,
включають:
сильний біль вуха;
набряк коло вуха;
нудота, блювання;
сильний біль голови;
запаморочення, порушення рівноваги;
асиметрія обличчя.
Ви також повинні звернутися до лікаря, якщо маєте повторні випадки середнього отиту,
оскільки це може бути ознакою прихованих проблем.
Які ускладнення гострого середнього отиту?
Ускладнення гострого середнього отиту трапляються дуже рідко, але вони серйозні і
можуть загрожувати життю. Запалення може поширитися в межах вискової кістки –
може виникнути запалення соскоподібного відростка (мастоїдит), ураження лицевого
69
нерва (з’являється асиметрія обличчя), гнійне запалення лабіринту внутрішнього вуха
(лабіринтит). Запалення також може перейти в порожнину черепа і тоді може виникнути
менінгіт чи абсцес мозку. Надзвичайно рідко отит є причиною сепсису.
Попередження: Ця інформація носить лише ознайомчий характер, вона не замінює
спілкування з лікарем і її не слід використовувати для діагностики чи лікування хвороби.
Щодо діагностики та лікування захворювання консультуйтеся з Вашим лікарем.
Алгоритм первинного обстеження пацієнта з підозрою на гострий середній отит
Пацієнт
з
Збір скарг та анамнезу
Лікарський огляд
факторами ризику
Оцінка ступеня тяжкості
-
Наявність
симптомів
ГСО
ускладнень ГСО
+
Проведення диференційної
діагностики
Встановлення діагнозу з
наступною госпіталізацією
пацієнта
до
Формулювання діагнозу
спеціалізованого відділення
+
Відповідає критеріям ГСО
-
Ведення
відповідно
до
встановленого діагнозу
Надання пацієнту інформації щодо
природного перебігу хвороби, імовірних
ускладнень
та
сучасних
методів
лікування. Прийняття зваженого рішення
та призначення лікування
70
Алгоритм ведення пацієнтів (дорослих та дітей) з гострим середнім отитом без
перфорації лікарями, які надають первинну медичну допомогу
71
Алгоритм ведення пацієнтів (дорослих та дітей) з гострим середнім отитом з
перфорацією лікарями, які надають первинну медичну допомогу
72
ЛІТЕРАТУРА
THE DIAGNOSIS AND MANAGEMENT OF ACUTE OTITIS MEDIA, 2013
1. American Academy of Pediatrics Subcommittee on Management of Acute Otitis Media.
Diagnosis
and
management
of
acute
otitis
media.
Pediatrics.
2004;113(5):1451–
1465pmid:15121972
2. Grijalva CG, Nuorti JP, Griffin MR . Antibiotic prescription rates for acute respiratory
tract infections in US ambulatory settings. JAMA. 2009;302(7):758–766pmid:19690308
3. McCaig LF, Besser RE, Hughes JM. Trends in antimicrobial prescribing rates for children
and adolescents. JAMA. 2002;287(23):3096–3102pmid:12069672
4. Vernacchio L, Vezina RM, Mitchell AA . Management of acute otitis media by primary
care physicians: trends since the release of the 2004 American Academy of Pediatrics/American
Academy of Family Physicians clinical practice guideline. Pediatrics. 2007;120(2):281–
287pmid:17671053
5. Coco A, Vernacchio L, Horst M, Anderson A. Management of acute otitis media after
publication of the 2004 AAP and AAFP clinical practice guideline. Pediatrics. 2010;125(2):214–
220pmid:20100746
6. Marchisio P, Mira E, Klersy C, et al . Medical education and attitudes about acute otitis
media guidelines: a survey of Italian pediatricians and otolaryngologists. Pediatr Infect Dis J.
2009;28(1):1–4pmid:19034062
7. Arkins ER, Koehler JM. Use of the observation option and compliance with guidelines in
treatment of acute otitis media. Ann Pharmacother. 2008;42(5):726–727pmid:18413696
8. Flores G, Lee M, Bauchner H, Kastner B. Pediatricians’ attitudes, beliefs, and practices
regarding clinical practice guidelines: a national survey. Pediatrics. 2000;105(3 pt 1):496–
501pmid:10699099
9. Bluestone CD. Definitions, terminology, and classification. In: Rosenfeld RM, Bluestone
CD, eds. Evidence-Based Otitis Media. Hamilton, Canada: BC Decker; 2003:120–135
10. Bluestone CD, Klein JO. Definitions, terminology, and classification. In: Bluestone CD,
Klein JO, eds. Otitis Media in Infants and Children. 4th ed. Hamilton, Canada: BC Decker; 2007:1–
19
11. Dowell SF, Marcy MS, Phillips WR, et al. Otitis media: principles of judicious use of
antimicrobial agents. Pediatrics. 1998;101(suppl):165–171
12. Rosenfeld RM. Clinical pathway for acute otitis media. In: Rosenfeld RM, Bluestone
CD, eds. Evidence-Based Otitis Media. 2nd ed. Hamilton, Canada: BC Decker; 2003:280–302
13. Carlson LH, Carlson RD. Diagnosis. In: Rosenfeld RM, Bluestone CD, eds. Evidence-
Based Otitis Media. Hamilton, Canada: BC Decker; 2003: 136–146
14. Bluestone CD, Klein JO. Diagnosis. In: Otitis Media in Infants and Children. 4th ed.
Hamilton, Canada: BC Decker; 2007:147–212
15. University of Oxford, Centre for Evidence Based Medicine. Available at:
www.cebm.net/index.aspx?o=1044. Accessed July 17, 2012
16. American Academy of Pediatrics Steering Committee on Quality Improvement and
Management . Classifying recommendations for clinical practice guidelines. Pediatrics.
2004;114(3):874–877pmid:15342869
17. Marcy M, Takata G, Shekelle P, et al. Management of Acute Otitis Media. Evidence
Report/Technology Assessment No. 15. Rockville, MD: Agency for Healthcare Research and
Quality; 2000
18. Chan LS, Takata GS, Shekelle P, Morton SC, Mason W, Marcy SM. Evidence
assessment of management of acute otitis media: II. Research gaps and priorities for future research.
Pediatrics. 2001;108(2):248–254pmid:11483784
19. Takata GS, Chan LS, Shekelle P, Morton SC, Mason W, Marcy SM. Evidence
assessment of management of acute otitis media: I. The role of antibiotics in treatment of
uncomplicated acute otitis media. Pediatrics. 2001;108(2):239–247pmid:11483783
73
20. OpenUrlShekelle PG, Takata G, Newberry SJ, et al. Management of Acute Otitis Media:
Update. Evidence Report/Technology Assessment No. 198. Rockville, MD: Agency for Healthcare
Research and Quality; 2010
21. Coker TR, Chan LS, Newberry SJ, et al. Diagnosis, microbial epidemiology, and
antibiotic treatment of acute otitis media in children: a systematic review. JAMA.
2010;304(19):2161–2169pmid:21081729
22. Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized
clinical trials: is blinding necessary? Control Clin Trials. 1996;17(1):1–12pmid:8721797
23. Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of
QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic
reviews. BMC Med Res Methodol. 2003;3:25pmid:14606960
24. Guyatt GH, Oxman AD, Vist GE, et al., GRADE Working Group. GRADE: an
emerging consensus on rating quality of evidence and strength of recommendations. BMJ.
2008;336(7650):924–926pmid:18436948
25. Hoffman RN, Michel G, Rosenfeld RM, Davidson C. Building better guidelines with
BRIDGE-Wiz: development and evaluation of a software assistant to promote clarity, transparency,
and implementability. J Am Med Inform Assoc. 2012;19(1):94–101pmid:20711085
26. Kalu SU, Ataya RS, McCormick DP, Patel JA, Revai K, Chonmaitree T. Clinical
spectrum of acute otitis media complicating upper respiratory tract viral infection. Pediatr Infect Dis
J. 2011;30(2):95–99pmid:20711085
27. Block SL, Harrison CJ. Diagnosis and Management of Acute Otitis Media. 3rd ed.
Caddo, OK: Professional Communications; 2005:48–50
28. Wald ER. Acute otitis media: more trouble with the evidence. Pediatr Infect Dis J.
2003;22(2):103–104pmid:12586970
29. Paradise JL, Rockette HE, Colborn DK, et al. Otitis media in 2253 Pittsburgh-area
infants: prevalence and risk factors during the first two years of life. Pediatrics. 1997;99(3):318–
333pmid:9041282
30. McCormick DP, Chonmaitree T, Pittman C, et al. Nonsevere acute otitis media: a
clinical trial comparing outcomes of watchful waiting versus immediate antibiotic treatment.
Pediatrics. 2005;115(6):1455–1465pmid:15930204
31. Hoberman A, Paradise JL, Rockette HE, et al. Treatment of acute otitis media in
children under 2 years of age. N Engl J Med. 2011;364(2):105–115pmid:21226576
32. Tähtinen PA, Laine MK, Huovinen P, Jalava J, Ruuskanen O, Ruohola A. A placebo-
controlled trial of antimicrobial treatment for acute otitis media. N Engl J Med. 2011;364(2):116–
126pmid:21226577
33. Shaikh N, Hoberman A, Paradise JL, et al. Development and preliminary evaluation of a
parent-reported outcome instrument for clinical trials in acute otitis media. Pediatr Infect Dis J.
2009;28(1):5–8pmid:19077917
34. Laine MK, Tähtinen PA, Ruuskanen O, Huovinen P, Ruohola A. Symptoms or
symptom-based scores cannot predict acute otitis media at otitis-prone age. Pediatrics. 2010;125(5).
Available at:
www.pediatrics.org/cgi/content/full/125/5/e1154pmid:20368317
35. Friedman NR, McCormick DP, Pittman C, et al. Development of a practical tool for
assessing the severity of acute otitis media. Pediatr Infect Dis J. 2006;25(2):101–
107pmid:16462284
36. Rothman R, Owens T, Simel DL. Does this child have acute otitis media? JAMA.
2003;290(12):1633–1640pmid:14506123
37. Niemela M, Uhari M, Jounio-Ervasti K, Luotonen J, Alho OP, Vierimaa E. Lack of
specific symptomatology in children with acute otitis media. Pediatr Infect Dis J. 1994;13(9):765–
768pmid:7808842
38. Heikkinen T, Ruuskanen O. Signs and symptoms predicting acute otitis media. Arch
Pediatr Adolesc Med. 1995;149(1):26–29pmid:7827655
74
39. Ingvarsson L. Acute otalgia in children—findings and diagnosis. Acta Paediatr Scand.
1982;71(5):705–710pmid:6891167
40. Kontiokari T, Koivunen P, Niemelä M, Pokka T, Uhari M. Symptoms of acute otitis
media. Pediatr Infect Dis J. 1998;17(8):676–679pmid:9726339
41. Wong DL, Baker CM. Pain in children: comparison of assessment scales. Pediatr Nurs.
1988;14(1):9–17pmid:3344163
42. Shaikh N, Hoberman A, Paradise JL, et al. Responsiveness and construct validity of a
symptom scale for acute otitis media. Pediatr Infect Dis J. 2009;28(1):9–12pmid:19077916
43. Karma PH, Penttilä MA, Sipilä MM, Kataja MJ. Otoscopic diagnosis of middle ear
effusion in acute and non-acute otitis media. I. The value of different otoscopic findings. Int J
Pediatr Otorhinolaryngol. 1989;17(1):37–49pmid:2707977
44. McCormick DP, Lim-Melia E, Saeed K, Baldwin CD, Chonmaitree T. Otitis media: can
clinical findings predict bacterial or viral etiology? Pediatr Infect Dis J. 2000;19(3):256–
258pmid:10749473
45. Schwartz RH, Stool SE, Rodriguez WJ, Grundfast KM. Acute otitis media: toward a
more precise definition. Clin Pediatr (Phila). 1981;20(9):549–554pmid:7261530
46. Rosenfeld RM. Antibiotic prophylaxis for recurrent acute otitis media. In: Alper CM,
Bluestone CD, eds. Advanced Therapy of Otitis Media. Hamilton, Canada: BC Decker; 2004
47. Paradise J, Bernard B, Colborn D, Smith C, Rockette H, Pittsburgh-area Child
Development/Otitis Media Study Group. Otitis media with effusion: highly prevalent and often the
forerunner of acute otitis media during the first year of life [abstract]. Pediatr Res. 1993;33:121A
48. Roland PS, Smith TL, Schwartz SR, et al. Clinical practice guideline: cerumen
impaction. Otolaryngol Head Neck Surg. 2008;139(3 suppl 2):S1–S21pmid:18707628
49. Shaikh N, Hoberman A, Kaleida PH, Ploof DL, Paradise JL. Videos in clinical
medicine. Diagnosing otitis media—otoscopy and cerumen removal. N Engl J Med.
2010;362(20):e62pmid:20484393
50. Pichichero ME. Diagnostic accuracy, tympanocentesis training performance, and
antibiotic selection by pediatric residents in management of otitis media. Pediatrics.
2002;110(6):1064–1070pmid:12456901
51. Kaleida PH, Ploof DL, Kurs-Lasky M, et al. Mastering diagnostic skills: Enhancing
Proficiency in Otitis Media, a model for diagnostic skills training. Pediatrics. 2009;124(4).
Available at
: www.pediatrics.org/cgi/content/full/124/4/e714pmid:19786431
52. Kaleida PH, Ploof D. ePROM: Enhancing Proficiency in Otitis Media. Pittsburgh, PA:
University of Pittsburgh School of Medicine. Available at:
http://pedsed.pitt.edu. Accessed
December 31, 2011
53. Innovative Medical Education. A View Through the Otoscope: Distinguishing Acute
Otitis Media from Otitis Media with Effusion. Paramus, NJ: Innovative Medical Education; 2000
54. American Academy of Pediatrics. Section on Infectious Diseases. A view through the
otoscope: distinguishing acute otitis media from otitis media with effusion [video]. Available at:
http://www2.aap.org/sections/infectdis/video.cfm. Accessed January 20, 2012
55. Hayden GF, Schwartz RH. Characteristics of earache among children with acute otitis
media. Am J Dis Child. 1985;139(7):721–723pmid:4014096
56. Schechter NL. Management of pain associated with acute medical illness. In: Schechter
NL, Berde CB, Yaster M, eds. Pain in Infants, Children, and Adolescents. Baltimore, MD: Williams
& Wilkins; 1993:537–538
57. Rovers MM, Glasziou P, Appelman CL, et al. Predictors of pain and/or fever at 3 to 7
days for children with acute otitis media not treated initially with antibiotics: a meta-analysis of
individual patient data. Pediatrics. 2007;119(3):579–585pmid:17332211
58. Burke P, Bain J, Robinson D, Dunleavey J. Acute red ear in children: controlled trial of
nonantibiotic treatment in children: controlled trial of nonantibiotic treatment in general practice.
BMJ. 1991;303(6802):558–562pmid:1912887
75
59. Sanders S, Glasziou PP, DelMar C, Rovers M. Antibiotics for acute otitis media in
children [review]. Cochrane Database Syst Rev. 2009;(2):1–43
60. van Buchem FL, Dunk JH, van’t Hof MA. Therapy of acute otitis media: myringotomy,
antibiotics, or neither? A double-blind study in children. Lancet. 1981;2(8252):883–
887pmid:6117681
61. Thalin A, Densert O, Larsson A, et al. Is penicillin necessary in the treatment of acute
otitis media? In: Proceedings of the International Conference on Acute and Secretory Otitis Media.
Part 1. Amsterdam, Netherlands: Kugler Publications; 1986:441–446
62. Rovers MM, Glasziou P, Appelman CL, et al. Antibiotics for acute otitis media: an
individual patient data meta-analysis. Lancet. 2006;368(9545):1429–1435pmid:17055944
63. Bertin L, Pons G, d’Athis P, et al. A randomized, double-blind, multicentre controlled
trial of ibuprofen versus acetaminophen and placebo for symptoms of acute otitis media in children.
Fundam Clin Pharmacol. 1996;10(4):387–392pmid:8871138
64. American Academy of Pediatrics. Committee on Psychosocial Aspects of Child and
Family Health, Task Force on Pain in Infants, Children, and Adolescents . The assessment and
management of acute pain in infants, children, and adolescents. Pediatrics. 2001;108(3):793–
797pmid:11533354
65. Bolt P, Barnett P, Babl FE, Sharwood LN. Topical lignocaine for pain relief in acute
otitis media: results of a double-blind placebo-controlled randomised trial. Arch Dis Child.
2008;93(1):40–44pmid:18156478
66. Foxlee R, Johansson AC, Wejfalk J, Dawkins J, Dooley L, Del Mar C. Topical analgesia
for acute otitis media. Cochrane Database Syst Rev. 2006;(3):CD005657pmid:16856108
67. Hoberman A, Paradise JL, Reynolds EA, Urkin J. Efficacy of Auralgan for treating ear
pain in children with acute otitis media. Arch Pediatr Adolesc Med. 1997;151(7):675–
678pmid:9232040
68. Sarrell EM, Mandelberg A, Cohen HA. Efficacy of naturopathic extracts in the
management of ear pain associated with acute otitis media. Arch Pediatr Adolesc Med.
2001;155(7):796–799pmid:11434846
69. Sarrell EM, Cohen HA, Kahan E. Naturopathic treatment for ear pain in children.
Pediatrics. 2003;111(5 pt 1):e574–e579pmid:12728112
70. Adam D, Federspil P, Lukes M, Petrowicz O. Therapeutic properties and tolerance of
procaine and phenazone containing ear drops in infants and very young children.
Arzneimittelforschung. 2009;59(10):504–512pmid:19998578
71. Barnett ED, Levatin JL, Chapman EH, et al. Challenges of evaluating homeopathic
treatment of acute otitis media. Pediatr Infect Dis J. 2000;19(4):273–275pmid:10783013
72. Jacobs J, Springer DA, Crothers D. Homeopathic treatment of acute otitis media in
children: a preliminary randomized placebo-controlled trial. Pediatr Infect Dis J. 2001;20(2):177–
183pmid:11224838
73. Rosenfeld RM, Bluestone CD. Clinical efficacy of surgical therapy. In: Rosenfeld RM,
Bluestone CD, eds. Evidence-Based Otitis Media. 2003. Hamilton, Canada: BC Decker; 2003:227–
240
74. Rosenfeld RM. Observation option toolkit for acute otitis media. Int J Pediatr
Otorhinolaryngol. 2001;58(1):1–8pmid:11249974
75. Le Saux N, Gaboury I, Baird M, et al. A randomized, double-blind, placebo-controlled
noninferiority trial of amoxicillin for clinically diagnosed acute otitis media in children 6 months to
5 years of age. CMAJ. 2005;172(3):335–341pmid:15684116
76. Spiro DM, Tay KY, Arnold DH, Dziura JD, Baker MD, Shapiro ED. Wait-and-see
prescription for the treatment of acute otitis media: a randomized controlled trial. JAMA.
2006;296(10):1235–1241pmid:16968847
77. Neumark T, Mölstad S, Rosén C, et al. Evaluation of phenoxymethylpenicillin treatment
of acute otitis media in children aged 2–16. Scand J Prim Health Care. 2007;25(3):166–
171pmid:17846935
76
78. Chao JH, Kunkov S, Reyes LB, Lichten S, Crain EF. Comparison of two approaches to
observation therapy for acute otitis media in the emergency department. Pediatrics. 2008;121(5).
Available at:
www.pediatrics.org/cgi/content/full/121/5/e1352pmid:18450878
79. Spurling GK, Del Mar CB, Dooley L, Foxlee R. Delayed antibiotics for respiratory
infections. Cochrane Database Syst Rev. 2007;(3):CD004417pmid:17636757
80. Koopman L, Hoes AW, Glasziou PP, et al. Antibiotic therapy to prevent the
development of asymptomatic middle ear effusion in children with acute otitis media: a meta-
analysis of individual patient data. Arch Otolaryngol Head Neck Surg. 2008;134(2):128–
132pmid:18283152
81. Marchetti F, Ronfani L, Nibali SC, Tamburlini G, Italian Study Group on Acute Otitis
Media. Delayed prescription may reduce the use of antibiotics for acute otitis media: a prospective
observational study in primary care. Arch Pediatr Adolesc Med. 2005;159(7):679–
684pmid:15997003
82. Ho D, Rotenberg BW, Berkowitz RG. The relationship between acute mastoiditis and
antibiotic use for acute otitis media in children. Arch Otolaryngol Head Neck Surg. 2008;34(1):45–
48
83. Thompson PL, Gilbert RE, Long PF, Saxena S, Sharland M, Wong IC. Effect of
antibiotics for otitis media on mastoiditis in children: a retrospective cohort study using the United
Kingdom general practice research database. Pediatrics. 2009;123(2):424–430pmid:19171605
84. American Academy of Family Physicians, American Academy of Otolaryngology-Head
and Neck Surgery, American Academy of Pediatrics Subcommittee on Otitis Media With Effusion.
Otitis media with effusion. Pediatrics. 2004;113(5):1412–1429pmid:15121966
85. Rosenfeld RM, Culpepper L, Doyle KJ, et al., American Academy of Pediatrics
Subcommittee on Otitis Media with Effusion, American Academy of Family Physicians, American
Academy of Otolaryngology—Head and Neck Surgery. Clinical practice guideline: otitis media
with effusion. Otolaryngol Head Neck Surg. 2004;130(suppl 5):S95–S118pmid:15138413
86. Appelman CL, Claessen JQ, Touw-Otten FW, Hordijk GJ, de Melker RA. Co-amoxiclav
in recurrent acute otitis media: placebo controlled study. BMJ. 1991;303(6815):1450–
1452pmid:1773154
87. Burke P, Bain J, Robinson D, Dunleavey J. Acute red ear in children: controlled trial of
nonantibiotic treatment in children: controlled trial of nonantibiotic treatment in general practice.
BMJ. 1991;303(6802):558–562pmid:1912887
88. van Balen FA, Hoes AW, Verheij TJ, de Melker RA. Primary care based randomized,
double blind trial of amoxicillin versus placebo in children aged under 2 years. BMJ.
2000;320(7231):350–354pmid:10657332
89. Little P, Gould C, Williamson I, Moore M, Warner G, Dunleavey J. Pragmatic
randomised controlled trial of two prescribing strategies for childhood acute otitis media. BMJ.
2001;322(7282):336–342pmid:11159657
90. Mygind N, Meistrup-Larsen K-I, Thomsen J, Thomsen VF, Josefsson K, Sørensen H.
Penicillin in acute otitis media: a double-blind placebo-controlled trial. Clin Otolaryngol Allied Sci.
1981;6(1):5–13pmid:6791864
91. Kaleida PH, Casselbrant ML, Rockette HE, et al. Amoxicillin or myringotomy or both
for acute otitis media: results of a randomized clinical trial. Pediatrics. 1991;87(4):466–
474pmid:2011422
92. Shaikh N, Hoberman A, Paradise JL, et al. Responsiveness and construct validity of a
symptom scale for acute otitis media. Pediatr Infect Dis J. 2009;28(1):9–12pmid:19077916
93. Heikkinen T, Chonmaitree T. Importance of respiratory viruses in acute otitis media.
Clin Microbiol Rev. 003;16(2):230–241pmid:12692096
94. Halsted C, Lepow ML, Balassanian N, Emmerich J, Wolinsky E. Otitis media. Clinical
observations, microbiology, and evaluation of therapy. Am J Dis Child. 1968;115(5):542–
551pmid:4384577
77
95. Rosenfeld RM, Vertrees J, Carr J, et al. Clinical efficacy of antimicrobials for acute
otitis media: meta-analysis of 5,400 children from 33 randomized trials. J Pediatr.
1994;124(3):355–367pmid:8120703
96. McCormick DP, Chandler SM, Chonmaitree T. Laterality of acute otitis media: different
clinical and microbiologic characteristics. Pediatr Infect Dis J. 2007;26(7):583–588pmid:17596798
97. Appelman CLM, Bossen PC, Dunk JHM, Lisdonk EH, de Melker RA, van Weert
HCPM. NHG Standard Otitis Media Acuta (Guideline on acute otitis media of the Dutch College of
General Practitioners). Huisarts Wet. 1990;33:242–245
98. OpenUrlSwedish Medical Research Council. Treatment for acute inflammation of the
middle ear: consensus statement. Stockholm, Sweden: Swedish Medical Research Council; 2000.
Available at:
http://soapimg.icecube.snowfall.se/strama/Konsensut_ora_eng.pdf. Accessed July 18,
201
99. Scottish Intercollegiate Guideline Network. Diagnosis and management of childhood
otitis media in primary care. Edinburgh, Scotland: Scottish Intercollegiate Guideline Network;
2000. Available at:
www.sign.ac.uk/guidelines/fulltext/66/index.html. Accessed July 18, 201
100. National Institute for Health and Clinical Excellence, Centre for Clinical Practice.
Respiratory tract infections—antibiotic prescribing: prescribing of antibiotics for self-limiting
respiratory tract infections in adults and children in primary care. NICE Clinical Guideline 69.
London, United Kingdom: National Institute for Health and Clinical Excellence; July 2008.
Available at:
www.nice.org.uk/CG069. Accessed July 18, 2012
101. Marchisio P, Bellussi L, Di Mauro G, et al. Acute otitis media: from diagnosis to
prevention. Summary of the Italian guideline. Int J Pediatr Otorhinolaryngol. 2010;74(11):1209–
1216pmid:20843561
102. Siegel RM, Kiely M, Bien JP, et al. Treatment of otitis media with observation and a
safety-net antibiotic prescription. Pediatrics. 2003;112(3 pt 1):527–531pmid:12949278
103. Pshetizky Y, Naimer S, Shvartzman P. Acute otitis media—a brief explanation to
parents and antibiotic use. Fam Pract. 2003;20(4):417–419pmid:12876113
104. Pichichero ME, Casey JR. Emergence of a multiresistant serotype 19A pneumococcal
strain not included in the 7-valent conjugate vaccine as an otopathogen in children. JAMA.
2007;298(15):1772–1778pmid:17940232
105. Pichichero ME, Casey JR. Evolving microbiology and molecular epidemiology of
acute otitis media in the pneumococcal conjugate vaccine era. Pediatr Infect Dis J. 2007;26(suppl
10):S12–S16pmid:18049375
106. Nielsen HUK, Konradsen HB, Lous J, Frimodt-Møller N. Nasopharyngeal pathogens in
children with acute otitis media in a low-antibiotic use country. Int J Pediatr Otorhinolaryngol.
2004;68(9):1149–1155pmid:15302145
107. Pitkäranta A, Virolainen A, Jero J, Arruda E, Hayden FG. Detection of rhinovirus,
respiratory syncytial virus, and coronavirus infections in acute otitis media by reverse transcriptase
polymerase chain reaction. Pediatrics. 1998;102(2 pt 1):291–295pmid:9685428
108. Heikkinen T, Thint M, Chonmaitree T. Prevalence of various respiratory viruses in the
middle ear during acute otitis media. N Engl J Med. 1999;340(4):260–264pmid:9920949
109. Chonmaitree T. Acute otitis media is not a pure bacterial disease. Clin Infect Dis.
2006;43(11):1423–1425pmid:17083015
110. Williams JV, Tollefson SJ, Nair S, Chonmaitree T. Association of human
metapneumovirus with acute otitis media. Int J Pediatr Otorhinolaryngol. 2006;70(7):1189–
1193pmid:16427144
111. Chonmaitree T, Heikkinen T. Role of viruses in middle-ear disease. Ann N Y Acad Sci.
1997;830:143–157pmid:9616674
112. Klein JO, Bluestone CD. Otitis media. In: Feigin RD, Cherry JD, Demmler-Harrison
GJ, Kaplan SL, eds. Textbook of Pediatric Infectious Diseases. 6th ed. Philadelphia, PA: Saunders;
2009:216–237
78
113. Chonmaitree T, Revai K, Grady JJ, et al. Viral upper respiratory tract infection and
otitis media complication in young children. Clin Infect Dis. 2008;46(6):815–823pmid:18279042
114. Ruohola A, Meurman O, Nikkari S, et al. Microbiology of acute otitis media in
children with tympanostomy tubes: prevalences of bacteria and viruses. Clin Infect Dis.
2006;43(11):1417–1422pmid:17083014
115. Ruuskanen O, Arola M, Heikkinen T, Ziegler T. Viruses in acute otitis media:
increasing evidence for clinical significance. Pediatr Infect Dis J. 1991;10(6):425–
427pmid:1852537
116. Chonmaitree T. Viral and bacterial interaction in acute otitis media. Pediatr Infect Dis
J. 2000;19(suppl 5):S24–S30pmid:10821469
117. Nokso-Koivisto J, Räty R, Blomqvist S, et al. Presence of specific viruses in the middle
ear fluids and respiratory secretions of young children with acute otitis media. J Med Virol.
2004;72(2):241–248pmid:14695665
118. Bluestone CD, Klein JO. Microbiology. In: Bluestone CD, Klein JO, eds. Otitis Media
in Infants and Children. 4th ed. Hamilton, Canada: BC Decker; 2007:101–126
119. Del Beccaro MA, Mendelman PM, Inglis AF, et al. Bacteriology of acute otitis media:
a new perspective. J Pediatr. 1992;120(1):81–84pmid:1731029
120. Block SL, Harrison CJ, Hedrick JA, et al. Penicillin-resistant Streptococcus
pneumoniae in acute otitis media: risk factors, susceptibility patterns and antimicrobial
management. Pediatr Infect Dis J. 1995;14(9):751–759pmid:8559623
121. Rodriguez WJ, Schwartz RH. Streptococcus pneumoniae causes otitis media with
higher fever and more redness of tympanic membranes than Haemophilus influenzae or Moraxella
catarrhalis. Pediatr Infect Dis J. 1999;18(10):942–944pmid:10530598
122. Block SL, Hedrick J, Harrison CJ, et al. Community-wide vaccination with the
heptavalent pneumococcal conjugate significantly alters the microbiology of acute otitis media.
Pediatr Infect Dis J. 2004;23(9):829–833pmid:15361721
123. Casey JR, Pichichero ME. Changes in frequency and pathogens causing acute otitis
media in 1995–2003. Pediatr Infect Dis J. 2004;23(9):824–828pmid:15361720
124. McEllistrem MC, Adams JM, Patel K, et al. Acute otitis media due to penicillin-
nonsusceptible Streptococcus pneumoniae before and after the introduction of the pneumococcal
conjugate vaccine. Clin Infect Dis. 2005;40(12):1738–1744pmid:15909260
125. Casey JR, Adlowitz DG, Pichichero ME. New patterns in the otopathogens causing
acute otitis media six to eight years after introduction of pneumococcal conjugate vaccine. Pediatr
Infect Dis J. 2010;29(4):304–309pmid:19935445
126. Grubb MS, Spaugh DC. Microbiology of acute otitis media, Puget Sound region, 2005–
2009. Clin Pediatr (Phila). 2010;49(8):727–730pmid:20185479
127. Revai K, McCormick DP, Patel J, Grady JJ, Saeed K, Chonmaitree T. Effect of
pneumococcal conjugate vaccine on nasopharyngeal bacterial colonization during acute otitis
media. Pediatrics. 2006;117(5):1823–1829pmid:16651345
128. Pettigrew MM, Gent JF, Revai K, Patel JA, Chonmaitree T. Microbial interactions
during upper respiratory tract infections. Emerg Infect Dis. 2008;14(10):1584–1591pmid:18826823
129. O’Brien KL, Millar EV, Zell ER, et al. Effect of pneumococcal conjugate vaccine on
nasopharyngeal colonization among immunized and unimmunized children in a community-
randomized trial. J Infect Dis. 2007;196(8):1211–1220pmid:17955440
130. OpenUrlJacobs MR, Bajaksouzian S, Windau A, Good C. Continued emergence of
nonvaccine serotypes of Streptococcus pneumoniae in Cleveland. Proceedings of the 49th
Interscience Conference on Antimicrobial Agents and Chemotherapy; 2009:G1-G1556
131. Hoberman A, Paradise JL, Shaikh N, et al. Pneumococcal resistance and serotype 19A
in Pittsburgh-area children with acute otitis media before and after introduction of 7-valent
pneumococcal polysaccharide vaccine. Clin Pediatr (Phila). 2011;50(2):114–120pmid:21098526
79
132. Huang SS, Hinrichsen VL, Stevenson AE, et al. Continued impact of pneumococcal
conjugate vaccine on carriage in young children. Pediatrics. 2009;124(1). Available at:
www.pediatrics.org/cgi/content/full/124/1/e1pmid:19564254
133. Centers for Disease Control and Prevention (CDC). Licensure of a 13-valent
pneumococcal conjugate vaccine (PCV13) and recommendations for use among children—
Advisory Committee on Immunization Practices (ACIP), 2010. MMWR Morb Mortal Wkly Rep.
2010;59(9):258–261pmid:20224542
134. Segal N, Givon-Lavi N, Leibovitz E, Yagupsky P, Leiberman A, Dagan R. Acute otitis
media caused by Streptococcus pyogenes in children. Clin Infect Dis. 2005;41(1):35–
41pmid:15937760
135. Luntz M, Brodsky A, Nusem S, et al. Acute mastoiditis—the antibiotic era: a
multicenter study. Int J Pediatr Otorhinolaryngol. 2001;57(1):1–9pmid:11165635
136. Nielsen JC. Studies on the Aetiology of Acute Otitis Media. Copenhagen, Denmark:
Ejnar Mundsgaard Forlag; 1945
137. Palmu AA, Herva E, Savolainen H, Karma P, Mäkelä PH, Kilpi TM. Association of
clinical signs and symptoms with bacterial findings in acute otitis media. Clin Infect Dis.
2004;38(2):234–242pmid:14699456
138. Leibovitz E, Asher E, Piglansky L, et al. Is bilateral acute otitis media clinically
different than unilateral acute otitis media? Pediatr Infect Dis J. 2007;26(7):589–
592pmid:17596799
139. Leibovitz E, Satran R, Piglansky L, et al. Can acute otitis media caused by
Haemophilus influenzae be distinguished from that caused by Streptococcus pneumoniae? Pediatr
Infect Dis J. 2003;22(6):509–515pmid:12799507
140. Palmu AA, Kotikoski MJ, Kaijalainen TH, Puhakka HJ. Bacterial etiology of acute
myringitis in children less than two years of age. Pediatr Infect Dis J. 2001;20(6):607–
611pmid:11419504
141. Bodor FF. Systemic antibiotics for treatment of the conjunctivitis-otitis media
syndrome. Pediatr Infect Dis J. 1989;8(5):287–290pmid:2631693
142. Bingen E, Cohen R, Jourenkova N, Gehanno P. Epidemiologic study of conjunctivitis-
otitis syndrome. Pediatr Infect Dis J. 2005;24(8):731–732pmid:16094231
143. Barkai G, Leibovitz E, Givon-Lavi N, Dagan R. Potential contribution by nontypable
Haemophilus influenzae in protracted and recurrent acute otitis media. Pediatr Infect Dis J.
2009;28(6):466–471pmid:19504729
144. Howie VM, Ploussard JH. Efficacy of fixed combination antibiotics versus separate
components in otitis media. Effectiveness of erythromycin estrolate, triple sulfonamide, ampicillin,
erythromycin estolate- triple sulfonamide, and placebo in 280 patients with acute otitis media under
two and one-half years of age. Clin Pediatr (Phila). 1972;11(4):205–214pmid:4537206
145. Klein JO. Microbiologic efficacy of antibacterial drugs for acute otitis media. Pediatr
Infect Dis J. 1993;12(12):973–975pmid:8108222
146. Barnett ED, Klein JO. The problem of resistant bacteria for the management of acute
otitis media. Pediatr Clin North Am. 1995;42(3):509–517pmid:7761138
147. Tristram S, Jacobs MR, Appelbaum PC. Antimicrobial resistance in Haemophilus
influenzae. Clin Microbiol Rev. 2007;20(2):368–389pmid:17428889
148. Critchley IA, Jacobs MR, Brown SD, Traczewski MM, Tillotson GS, Janjic N.
Prevalence of serotype 19A Streptococcus pneumoniae among isolates from U.S. children in
2005≠2006 and activity of faropenem. Antimicrob Agents Chemother. 2008;52(7):2639–
2643pmid:18443117
149. Jacobs MR, Good CE, Windau AR, et al. Activity of ceftaroline against emerging
serotypes of Streptococcus pneumoniae. Antimicrob Agents Chemother. 2010;54(6):2716–
2719pmid:20308374
150. Jacobs MR. Antimicrobial-resistant Streptococcus pneumoniae: trends and
management. Expert Rev Anti Infect Ther. 008;6(5):619–635pmid:18847402
80
151. Piglansky L, Leibovitz E, Raiz S, et al. Bacteriologic and clinical efficacy of high dose
amoxicillin for therapy of acute otitis media in children. Pediatr Infect Dis J. 2003;22(5):405–
413pmid:12792379
152. Dagan R, Johnson CE, McLinn S, et al. Bacteriologic and clinical efficacy of
amoxicillin/clavulanate vs. azithromycin in acute otitis media. Pediatr Infect Dis J. 2000;19(2):95–
104pmid:10693993
153. Dagan R, Hoberman A, Johnson C, et al. Bacteriologic and clinical efficacy of high
dose amoxicillin/clavulanate in children with acute otitis media. Pediatr Infect Dis J.
2001;20(9):829–837pmid:11734759
154. Hoberman A, Dagan R, Leibovitz E, et al. Large dosage amoxicillin/clavulanate,
compared with azithromycin, for the treatment of bacterial acute otitis media in children. Pediatr
Infect Dis J. 2005;24(6):525–532pmid:15933563
155. De Wals P, Erickson L, Poirier B, Pépin J, Pichichero ME. How to compare the
efficacy of conjugate vaccines to prevent acute otitis media? Vaccine. 2009;27(21):2877–
2883pmid:19366579
156. Shouval DS, Greenberg D, Givon-Lavi N, Porat N, Dagan R. Serotype coverage of
invasive and mucosal pneumococcal disease in Israeli children younger than 3 years by various
pneumococcal conjugate vaccines. Pediatr Infect Dis J. 2009;28(4):277–282pmid:19258924
157. Jones RN, Farrell DJ, Mendes RE, Sader HS. Comparative ceftaroline activity tested
against pathogens associated with community-acquired pneumonia: results from an international
surveillance study. J Antimicrob Chemother. 2011;66(suppl 3):iii69–iii80pmid:21482572
158. Harrison CJ, Woods C, Stout G, Martin B, Selvarangan R. Susceptibilities of
Haemophilus influenzae, Streptococcus pneumoniae, including serotype 19A, and Moraxella
catarrhalis paediatric isolates from 2005 to 2007 to commonly used antibiotics. J Antimicrob
Chemother. 2009;63(3):511–519pmid:19174454
159. Doern GV, Jones RN, Pfaller MA, Kugler K. Haemophilus influenzae and Moraxella
catarrhalis from patients with community-acquired respiratory tract infections: antimicrobial
susceptibility patterns from the SENTRY antimicrobial Surveillance Program (United States and
Canada, 1997). Antimicrob Agents Chemother. 1999;43(2):385–389pmid:9925540
160. Nussinovitch M, Yoeli R, Elishkevitz K, Varsano I. Acute mastoiditis in children:
epidemiologic, clinical, microbiologic, and therapeutic aspects over past years. Clin Pediatr (Phila).
2004;43(3):261–267pmid:15094950
161. Roddy MG, Glazier SS, Agrawal D. Pediatric mastoiditis in the pneumococcal
conjugate vaccine era: symptom duration guides empiric antimicrobial therapy. Pediatr Emerg Care.
2007;23(11):779–784pmid:18007207
162. Hoberman A, Paradise JL, Burch DJ, et al. Equivalent efficacy and reduced occurrence
of diarrhea from a new formulation of amoxicillin/clavulanate potassium (Augmentin) for treatment
of acute otitis media in children. Pediatr Infect Dis J. 1997;16(5):463–470pmid:9154538
163. Arguedas A, Dagan R, Leibovitz E, Hoberman A, Pichichero M, Paris M. A
multicenter, open label, double tympanocentesis study of high dose cefdinir in children with acute
otitis media at high risk of persistent or recurrent infection. Pediatr Infect Dis J. 2006;25(3):211–
218pmid:16511382
164. Atanasković-Marković M, Velicković TC, Gavrović-Jankulović M, Vucković O,
Nestorović B. Immediate allergic reactions to cephalosporins and penicillins and their cross-
reactivity in children. Pediatr Allergy Immunol. 2005;16(4):341–347pmid:15943598
165. Pichichero ME. Use of selected cephalosporins in penicillin-allergic patients: a
paradigm shift. Diagn Microbiol Infect Dis. 2007;57(suppl 3):13S–18Spmid:17349459
166. Pichichero ME, Casey JR. Safe use of selected cephalosporins in penicillin-allergic
patients: a meta-analysis. Otolaryngol Head Neck Surg. 2007;136(3):340–347pmid:17321857
167. OpenUrlDePestel DD, Benninger MS, Danziger L, et al. Cephalosporin use in
treatment of patients with penicillin allergies. J Am Pharm Assoc (2003). 2008;48(4):530–540
81
168. Fonacier L, Hirschberg R, Gerson S. Adverse drug reactions to a cephalosporins in
hospitalized patients with a history of penicillin allergy. Allergy Asthma Proc. 2005;26(2):135–
141pmid:15971473
169. Joint Task Force on Practice Parameters, American Academy of Allergy, Asthma and
Immunology, American College of Allergy, Asthma and Immunology, Joint Council of Allergy,
Asthma and Immunology. Drug allergy: an updated practice parameter. Ann Allergy Asthma
Immunol. 2010;105(4):259–273pmid:20934625
170. Powers JL, Gooch WM III, Oddo LP. Comparison of the palatability of the oral
suspension of cefdinir vs. amoxicillin/clavulanate potassium, cefprozil and azithromycin in
pediatric patients. Pediatr Infect Dis J. 2000;19(suppl 12):S174–S180pmid:11144401
171. Steele RW, Thomas MP, Bégué RE. Compliance issues related to the selection of
antibiotic suspensions for children. Pediatr Infect Dis J. 2001;20(1):1–5pmid:11176558
172. Steele RW, Russo TM, Thomas MP. Adherence issues related to the selection of
antistaphylococcal or antifungal antibiotic suspensions for children. Clin Pediatr (Phila).
2006;45(3):245–250pmid:16708137
173. Schwartz RH. Enhancing children’s satisfaction with antibiotic therapy: a taste study of
several antibiotic suspensions. Curr Ther Res. 2000;61(8):570–581
174. Green SM, Rothrock SG. Single-dose intramuscular ceftriaxone for acute otitis media
in children. Pediatrics. 1993;91(1):23–30pmid:8416502
175. Leibovitz E, Piglansky L, Raiz S, Press J, Leiberman A, Dagan R. Bacteriologic and
clinical efficacy of one day vs. three day intramuscular ceftriaxone for treatment of nonresponsive
acute otitis media in children. Pediatr Infect Dis J. 2000;19(11):1040–1045pmid:11099083
176. Rosenfeld RM, Kay D. Natural history of untreated otitis media. Laryngoscope.
2003;113(10):1645–1657pmid:14520089
177. Rosenfeld RM, Kay D. Natural history of untreated otitis media. In: Rosenfeld RM,
Bluestone CD, eds. Evidence-Based Otitis Media. 2nd ed. Hamilton, Canada: BC Decker;
2003:180–198
178. Arola M, Ziegler T, Ruuskanen O. Respiratory virus infection as a cause of prolonged
symptoms in acute otitis media. J Pediatr. 1990;116(5):697–701pmid:2329417
179. Chonmaitree T, Owen MJ, Howie VM. Respiratory viruses interfere with bacteriologic
response to antibiotic in children with acute otitis media. J Infect Dis. 1990;162(2):546–
549pmid:2373879
180. Dagan R, Leibovitz E, Greenberg D, Yagupsky P, Fliss DM, Leiberman A. Early
eradication of pathogens from middle ear fluid during antibiotic treatment of acute otitis media is
associated with improved clinical outcome. Pediatr Infect Dis J. 1998;17(9):776–782pmid:9779760
181. Carlin SA, Marchant CD, Shurin PA, Johnson CE, Super DM, Rehmus JM. Host
factors and early therapeutic response in acute otitis media. J Pediatr. 1991;118(2):178–
183pmid:1899699
182. Teele DW, Pelton SI, Klein JO. Bacteriology of acute otitis media unresponsive to
initial antimicrobial therapy. J Pediatr. 1981;98(4):537–539pmid:6970803
183. Doern GV, Pfaller MA, Kugler K, Freeman J, Jones RN. Prevalence of antimicrobial
resistance among respiratory tract isolates of Streptococcus pneumoniae in North America: 1997
results from the SENTRY antimicrobial surveillance program. Clin Infect Dis. 1998;27(4):764–
770pmid:9798031
184. Leiberman A, Leibovitz E, Piglansky L, et al. Bacteriologic and clinical efficacy of
trimethoprim-sulfamethoxazole for treatment of acute otitis media. Pediatr Infect Dis J.
2001;20(3):260–264pmid:11303827
185. Humphrey WR, Shattuck MH, Zielinski RJ, et al. Pharmacokinetics and efficacy of
linezolid in a gerbil model of Streptococcus pneumoniae-induced acute otitis media. Antimicrob
Agents Chemother. 2003;47(4):1355–1363pmid:12654670
82
186. Arguedas A, Dagan R, Pichichero M, et al. An open-label, double tympanocentesis
study of levofloxacin therapy in children with, or at high risk for, recurrent or persistent acute otitis
media. Pediatr Infect Dis J. 2006;25(12):1102–1109pmid:17133154
187. Noel GJ, Blumer JL, Pichichero ME, et al. A randomized comparative study of
levofloxacin versus amoxicillin/clavulanate for treatment of infants and young children with
recurrent or persistent acute otitis media. Pediatr Infect Dis J. 2008;27(6):483–489pmid:18449063
188. Howie VM, Ploussard JH. Simultaneous nasopharyngeal and middle ear exudate
culture in otitis media. Pediatr Digest. 1971;13:31–35
189. Gehanno P, Lenoir G, Barry B, Bons J, Boucot I, Berche P. Evaluation of
nasopharyngeal cultures for bacteriologic assessment of acute otitis media in children. Pediatr Infect
Dis J. 1996;15(4):329–332pmid:8866802
190. Cohen R, Levy C, Boucherat M, Langue J, de La Rocque F. A multicenter,
randomized, double-blind trial of 5 versus 10 days of antibiotic therapy for acute otitis media in
young children. J Pediatr. 1998;133(5):634–639pmid:9821420
191. Pessey JJ, Gehanno P, Thoroddsen E, et al. Short course therapy with cefuroxime axetil
for acute otitis media: results of a randomized multicenter comparison with amoxicillin/clavulanate.
Pediatr Infect Dis J. 1999;18(10):854–859pmid:10530579
192. Cohen R, Levy C, Boucherat M, et al. Five vs. ten days of antibiotic therapy for acute
otitis media in young children. Pediatr Infect Dis J. 2000;19(5):458–463pmid:10819344
193. Pichichero ME, Marsocci SM, Murphy ML, Hoeger W, Francis AB, Green JL. A
prospective observational study of 5-, 7-, and 10-day antibiotic treatment for acute otitis media.
Otolaryngol Head Neck Surg. 2001;124(4):381–387pmid:11283494
194. Kozyrskyj AL, Klassen TP, Moffatt M, Harvey K. Short-course antibiotics for acute
otitis media. Cochrane Database Syst Rev. 2010;(9):CD001095pmid:20824827
195. Shurin PA, Pelton SI, Donner A, Klein JO. Persistence of middle-ear effusion after
acute otitis media in children. N Engl J Med. 1979;300(20):1121–1123pmid:431635
196. Damoiseaux RA, Rovers MM, Van Balen FA, Hoes AW, de Melker RA. Long-term
prognosis of acute otitis media in infancy: determinants of recurrent acute otitis media and
persistent middle ear effusion. Fam Pract. 2006;23(1):40–45pmid:16107490
197. Leach AJ, Morris PS. Antibiotics for the prevention of acute and chronic suppurative
otitis media in children. Cochrane Database Syst Rev. 2006;(4):CD004401pmid:17054203
198. Teele DW, Klein JO, Word BM, et al., Greater Boston Otitis Media Study Group.
Antimicrobial prophylaxis for infants at risk for recurrent acute otitis media. Vaccine.
2000;19(suppl 1):S140–S143pmid:11163478
199. Paradise JL. On tympanostomy tubes: rationale, results, reservations, and
recommendations. Pediatrics. 1977;60(1):86–90pmid:876740
200. McIsaac WJ, Coyte PC, Croxford R, Asche CV, Friedberg J, Feldman W.
Otolaryngologists’ perceptions of the indications for tympanostomy tube insertion in children.
CMAJ. 2000;162(9):1285–1288pmid:10813009
201. Casselbrandt ML. Ventilation tubes for recurrent acute otitis media. In: Alper CM,
Bluestone CD, eds. Advanced Therapy of Otitis Media. Hamilton, Canada: BC Decker; 2004:113–
115
202. Shin JJ, Stinnett SS, Hartnick CJ. Pediatric recurrent acute otitis media. In: Shin JJ,
Hartnick CJ, Randolph GW, eds. Evidence-Based Otolaryngology. New York, NY: Springer;
2008:91–95
203. Gonzalez C, Arnold JE, Woody EA, et al. Prevention of recurrent acute otitis media:
chemoprophylaxis
versus
tympanostomy
tubes.
Laryngoscope.
1986;96(12):1330–
1334pmid:3537596
204. Gebhart DE. Tympanostomy tubes in the otitis media prone child. Laryngoscope.
1981;91(6):849–866pmid:7017311
83
205. Casselbrant ML, Kaleida PH, Rockette HE, et al. Efficacy of antimicrobial prophylaxis
and of tympanostomy tube insertion for prevention of recurrent acute otitis media: results of a
randomized clinical trial. Pediatr Infect Dis J. 1992;11(4):278–286pmid:1565551
206. El-Sayed Y. Treatment of recurrent acute otitis media chemoprophylaxis versus
ventilation tubes. Aust J Otolaryngol. 1996;2(4):352–355
207. McDonald S, Langton Hewer CD, Nunez DA. Grommets (ventilation tubes) for
recurrent
acute
otitis
media
in
children.
Cochrane
Database
Syst
Rev.
2008;(4):CD004741pmid:18843668
208. Rosenfeld RM, Bhaya MH, Bower CM, et al. Impact of tympanostomy tubes on child
quality of life. Arch Otolaryngol Head Neck Surg. 2000;126(5):585–592pmid:10807325
209. Witsell DL, Stewart MG, Monsell EM, et al. The Cooperative Outcomes Group for
ENT: a multicenter prospective cohort study on the outcomes of tympanostomy tubes for children
with otitis media. Otolaryngol Head Neck Surg. 2005;132(2):180–188pmid:15692524
210. Isaacson G. Six Sigma tympanostomy tube insertion: achieving the highest safety
levels
during
residency
training.
Otolaryngol
Head
Neck
Surg.
2008;139(3):353–
357pmid:18722211
211. Kay DJ, Nelson M, Rosenfeld RM. Meta-analysis of tympanostomy tube sequelae.
Otolaryngol Head Neck Surg. 2001;124(4):374–380pmid:11283489
212. Koivunen P, Uhari M, Luotonen J, et al. Adenoidectomy versus chemoprophylaxis and
placebo for recurrent acute otitis media in children aged under 2 years: randomised controlled trial.
BMJ. 2004;328(7438):487pmid:14769785
213. Rosenfeld RM. Surgical prevention of otitis media. Vaccine. 2000;19(suppl 1):S134–
S139pmid:11163477
214. Centers for Disease Control and Prevention (CDC). Prevention and control of influenza
with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP),
2011. MMWR Morb Mortal Wkly Rep. 2011;60(33):1128–1132pmid:21866086
215. American
Academy
of
Pediatrics
Committee
on
Infectious
Diseases.
Recommendations for prevention and control of influenza in children, 2011–2012. Pediatrics.
2011;128(4):813–825pmid:21890834
216. Section on Breastfeeding. Breastfeeding and the use of human milk. Pediatrics.
2012;129(3). Available at:
www.pediatrics.org/cgi/content/full/129/3/e827pmid:22371471
217. Pavia M, Bianco A, Nobile CG, Marinelli P, Angelillo IF. Efficacy of pneumococcal
vaccination in children younger than 24 months: a meta-analysis. Pediatrics. 2009;123(6). Available
at:
www.pediatrics.org/cgi/content/full/123/6/e1103pmid:19482744
218. Eskola J, Kilpi T, Palmu A, et al., Finnish Otitis Media Study Group. Efficacy of a
pneumococcal conjugate vaccine against acute otitis media. N Engl J Med. 2001;344(6):403–
409pmid:11172176
219. Black S, Shinefield H, Fireman B, et al., Northern California Kaiser Permanente
Vaccine Study Center Group. Efficacy, safety and immunogenicity of heptavalent pneumococcal
conjugate vaccine in children. Pediatr Infect Dis J. 2000;19(3):187–195pmid:10749457
220. Jacobs MR. Prevention of otitis media: role of pneumococcal conjugate vaccines in
reducing incidence and antibiotic resistance. J Pediatr. 2002;141(2):287–293pmid:12183732
221. Jansen AG, Hak E, Veenhoven RH, Damoiseaux RA, Schilder AG, Sanders EA.
Pneumococcal conjugate vaccines for preventing otitis media. Cochrane Database Syst Rev.
2009;(2):CD001480pmid:19370566
222. Fireman B, Black SB, Shinefield HR, Lee J, Lewis E, Ray P. Impact of the
pneumococcal conjugate vaccine on otitis media. Pediatr Infect Dis J. 2003;22(1):10–
16pmid:12544402
223. Grijalva CG, Poehling KA, Nuorti JP, et al. National impact of universal childhood
immunization with pneumococcal conjugate vaccine on otitis media. Pediatr Infect Dis J.
2006;118(3):865–873pmid:12544402
84
224. Zhou F, Shefer A, Kong Y, Nuorti JP. Trends in acute otitis media-related health care
utilization by privately insured young children in the United States, 1997–2004. Pediatrics.
2008;121(2):253–260pmid:18245415
225. Poehling KA, Szilagyi PG, Grijalva CG, et al. Reduction of frequent otitis media and
pressure-equalizing tube insertions in children after introduction of pneumococcal conjugate
vaccine. Pediatrics. 2007;119(4):707–715pmid:17403841
226. Pelton SI. Prospects for prevention of otitis media. Pediatr Infect Dis J. 2007;26(suppl
10):S20–S22pmid:18049377
227. Pelton SI, Leibovitz E. Recent advances in otitis media. Pediatr Infect Dis J.
2009;28(suppl 10):S133–S137pmid:19918136
228. De Wals P, Erickson L, Poirier B, Pépin J, Pichichero ME. How to compare the
efficacy of conjugate vaccines to prevent acute otitis media? Vaccine. 2009;27(21):2877–
2883pmid:19366579
229. Plasschaert AI, Rovers MM, Schilder AG, Verheij TJ, Hak E. Trends in doctor
consultations, antibiotic prescription, and specialist referrals for otitis media in children: 1995–
2003. Pediatrics. 2006;117(6):1879–1886pmid:16740826
230. O’Brien MA, Prosser LA, Paradise JL, et al. New vaccines against otitis media:
projected benefits and cost-effectiveness. Pediatrics. 2009;123(6):1452–1463pmid:19482754
231. Hanage WP, Auranen K, Syrjänen R, et al. Ability of pneumococcal serotypes and
clones to cause acute otitis media: implications for the prevention of otitis media by conjugate
vaccines. Infect Immun. 2004;72(1):76–81pmid:14688083
232. Prymula R, Peeters P, Chrobok V, et al. Pneumococcal capsular polysaccharides
conjugated to protein D for prevention of acute otitis media caused by both Streptococcus
pneumoniae and non-typable Haemophilus influenzae: a randomised double-blind efficacy study.
Lancet. 2006;367(9512):740–748pmid:16517274
233. Prymula R, Schuerman L. 10-valent pneumococcal nontypeable Haemophilus
influenzae PD conjugate vaccine: Synflorix. Expert Rev Vaccines. 2009;8(11):1479–
1500pmid:19863240
234. Schuerman L, Borys D, Hoet B, Forsgren A, Prymula R. Prevention of otitis media:
now a reality? Vaccine. 2009;27(42):5748–5754pmid:19666154
235. Heikkinen T, Ruuskanen O, Waris M, Ziegler T, Arola M, Halonen P. Influenza
vaccination in the prevention of acute otitis media in children. Am J Dis Child. 1991;145(4):445–
448pmid:1849344
236. Clements DA, Langdon L, Bland C, Walter E. Influenza A vaccine decreases the
incidence of otitis media in 6- to 30-month-old children in day care. Arch Pediatr Adolesc Med.
1995;149(10):1113–1117pmid:7550814
237. Belshe RB, Gruber WC. Prevention of otitis media in children with live attenuated
influenza vaccine given intranasally. Pediatr Infect Dis J. 2000;19(suppl 5):S66–
S71pmid:10821474
238. Marchisio P, Cavagna R, Maspes B, et al. Efficacy of intranasal virosomal influenza
vaccine in the prevention of recurrent acute otitis media in children. Clin Infect Dis.
2002;35(2):168–174pmid:12087523
239. Ozgur SK, Beyazova U, Kemaloglu YK, et al. Effectiveness of inactivated influenza
vaccine for prevention of otitis media in children. Pediatr Infect Dis J. 2006;25(5):401–
404pmid:16645502
240. Block SL, Heikkinen T, Toback SL, Zheng W, Ambrose CS. The efficacy of live
attenuated influenza vaccine against influenza-associated acute otitis media in children. Pediatr
Infect Dis J. 2011;30(3):203–207pmid:20935591
241. Ashkenazi S, Vertruyen A, Arístegui J, et al., CAIV-T Study Group. Superior relative
efficacy of live attenuated influenza vaccine compared with inactivated influenza vaccine in young
children with recurrent respiratory tract infections. Pediatr Infect Dis J. 2006;25(10):870–
879pmid:17006279
85
242. Belshe RB, Edwards KM, Vesikari T, et al., CAIV-T Comparative Efficacy Study
Group. Live attenuated versus inactivated influenza vaccine in infants and young children
[published correction appears in N Engl J Med. 2007;356(12):1283]. N Engl J Med.
2007;356(7):685–696pmid:17301299
243. Bracco Neto H, Farhat CK, Tregnaghi MW, et al., D153-P504 LAIV Study Group.
Efficacy and safety of 1 and 2 doses of live attenuated influenza vaccine in vaccine-naive children.
Pediatr Infect Dis J. 2009;28(5):365–371pmid:19395948
244. Tam JS, Capeding MR, Lum LC, et al., Pan-Asian CAIV-T Pediatric Efficacy Trial
Network. Efficacy and safety of a live attenuated, cold-adapted influenza vaccine, trivalent against
culture-confirmed influenza in young children in Asia. Pediatr Infect Dis J. 2007;26(7):619–
628pmid:17596805
245. Vesikari T, Fleming DM, Aristegui JF, et al., CAIV-T Pediatric Day Care Clinical Trial
Network. Safety, efficacy, and effectiveness of cold-adapted influenza vaccine-trivalent against
community-acquired, culture-confirmed influenza in young children attending day care. Pediatrics.
2006;118(6):2298–2312pmid:17142512
246. Forrest BD, Pride MW, Dunning AJ, et al. Correlation of cellular immune responses
with protection against culture-confirmed influenza virus in young children. Clin Vaccine Immunol.
2008;15(7):1042–1053pmid:18448618
247. Lum LC, Borja-Tabora CF, Breiman RF, et al. Influenza vaccine concurrently
administered with a combination measles, mumps, and rubella vaccine to young children. Vaccine.
2010;28(6):1566–1574pmid:20003918
248. Belshe RB, Mendelman PM, Treanor J, et al. The efficacy of live attenuated, cold-
adapted, trivalent, intranasal influenzavirus vaccine in children. N Engl J Med. 1998;338(20):1405–
1412pmid:9580647
249. Daly KA, Giebink GS. Clinical epidemiology of otitis media. Pediatr Infect Dis J.
2000;19(suppl 5):S31–S36pmid:10821470
250. Duncan B, Ey J, Holberg CJ, Wright AL, Martinez FD, Taussig LM. Exclusive breast-
feeding for at least 4 months protects against otitis media. Pediatrics. 1993;91(5):867–
872pmid:8474804
251. Duffy LC, Faden H, Wasielewski R, Wolf J, Krystofik D. Exclusive breastfeeding
protects against bacterial colonization and day care exposure to otitis media. Pediatrics.
1997;100(4). Available at:
www.pediatrics.org/cgi/content/full/100/4/e7pmid:9310540
252. Paradise JL. Short-course antimicrobial treatment for acute otitis media: not best for
infants and young children. JAMA. 1997;278(20):1640–1642pmid:9388072
253. Scariati PD, Grummer-Strawn LM, Fein SB. A longitudinal analysis of infant
morbidity and the extent of breastfeeding in the United States. Pediatrics. 1997;99(6). Available at:
www.pediatrics.org/cgi/content/full/99/6/e5pmid:9164801
254. McNiel ME, Labbok MH, Abrahams SW. What are the risks associated with formula
feeding? A re-analysis and review. Breastfeed Rev. 2010;18(2):25–32pmid:20879657
255. Chantry CJ, Howard CR, Auinger P. Full breastfeeding duration and associated
decrease in respiratory tract infection in US children. Pediatrics. 2006;117(2):425–
432pmid:16452362
256. Hatakka K, Piirainen L, Pohjavuori S, Poussa T, Savilahti E, Korpela R. Factors
associated with acute respiratory illness in day care children. Scand J Infect Dis. 2010;42(9):704–
711pmid:20465487
257. Ladomenou F, Kafatos A, Tselentis Y, Galanakis E. Predisposing factors for acute
otitis media in infancy. J Infect. 2010;61(1):49–53pmid:20394772
258. Ladomenou F, Moschandreas J, Kafatos A, Tselentis Y, Galanakis E. Protective effect
of exclusive breastfeeding against infections during infancy: a prospective study. Arch Dis Child.
2010;95(12):1004–1008pmid:20876557
86
259. Duijts L, Jaddoe VW, Hofman A, Moll HA. Prolonged and exclusive breastfeeding
reduces the risk of infectious diseases in infancy. Pediatrics. 2010;126(1). Available at:
www.pediatrics.org/cgi/content/full/126/1/e18pmid:20566605
260. Best D, Committee on Environmental Health, Committee on Native American Child
Health, Committee on Adolescence. From the American Academy of Pediatrics: technical report—
secondhand and prenatal tobacco smoke exposure. Pediatrics. 2009;124(5). Available at:
www.pediatrics.org/cgi/content/full/124/5/e1017pmid:19841110
261. Etzel RA, Pattishall EN, Haley NJ, Fletcher RH, Henderson FW. Passive smoking and
middle ear effusion among children in day care. Pediatrics. 1992;90(2 pt 1):228–232pmid:1641287
262. Ilicali OC, Keleş N, Değer K, Savaş I. Relationship of passive cigarette smoking to
otitis media. Arch Otolaryngol Head Neck Surg. 1999;125(7):758–762pmid:10406313
263. Wellington M, Hall CB. Pacifier as a risk factor for acute otitis media [letter].
Pediatrics. 2002;109(2):351–352, author reply 353pmid:11826228
264. Kerstein R. Otitis media: prevention instead of prescription. Br J Gen Pract.
2008;58(550):364–365pmid:18482495
265. Brown CE, Magnuson B. On the physics of the infant feeding bottle and middle ear
sequela: ear disease in infants can be associated with bottle feeding. Int J Pediatr Otorhinolaryngol.
2000;54(1):13–20pmid:10960691
266. Niemelä M, Pihakari O, Pokka T, Uhari M. Pacifier as a risk factor for acute otitis
media: a randomized, controlled trial of parental counseling. Pediatrics. 2000;106(3):483–
488pmid:10969091
267. Tully SB, Bar-Haim Y, Bradley RL. Abnormal tympanography after supine bottle
feeding. J Pediatr. 1995;126(6):S105–S111pmid:7776069
268. Rovers MM, Numans ME, Langenbach E, Grobbee DE, Verheij TJ, Schilder AG. Is
pacifier use a risk factor for acute otitis media? A dynamic cohort study. Fam Pract.
2008;25(4):233–236pmid:18562333
269. Adderson EE. Preventing otitis media: medical approaches. Pediatr Ann.
1998;27(2):101–107pmid:9523298
270. Azarpazhooh A, Limeback H, Lawrence HP, Shah PS. Xylitol for preventing acute
otitis media in children up to 12 years of age. Cochrane Database Syst Rev.
2011;(11):CD007095pmid:22071833
271. Hautalahti O, Renko M, Tapiainen T, Kontiokari T, Pokka T, Uhari M. Failure of
xylitol given three times a day for preventing acute otitis media. Pediatr Infect Dis J.
2007;26(5):423–427pmid:17468653
272. Tapiainen T, Luotonen L, Kontiokari T, Renko M, Uhari M. Xylitol administered only
during respiratory infections failed to prevent acute otitis media. Pediatrics. 2002;109(2). Available
at:
www.pediatrics.org/cgi/content/full/109/2/e19pmid:11826229
273. Uhari M, Kontiokari T, Koskela M, Niemelä M. Xylitol chewing gum in prevention of
acute otitis media: double blind randomised trial. BMJ. 1996;313(7066):1180–1184pmid:8916749
274. Uhari M, Kontiokari T, Niemelä M. A novel use of xylitol sugar in preventing acute
otitis media. Pediatrics. 1998;102(4 pt 1):879–884pmid:9755259
275. O’Brien MA, Prosser LA, Paradise JL, et al. New vaccines against otitis media:
projected benefits and cost-effectiveness. Pediatrics. 2009;123(6):1452–1463pmid:19482754
KOREAN CLINICAL PRACTICE GUIDELINES: OTITIS MEDIA IN CHILDREN, 2012
1. Korea Centers for Disease Control and Prevention. Korea health statistics 2009: Korea
national health and nutrition examination survey (KNHANES IV-3). Available at
http://www.who.int/healthinfo/global_burden_disease/2004_report_update/en/index.html (accessed
on 20 February 2012).
2. Terris MH, Magit AE, Davidson TM. Otitis media with effusion in infants and children.
Primary care concerns addressed from an otolaryngologist’s perspective. Postgrad Med 1995; 97:
137-8, 143-4, 147.
87
3. Kim CS, Jung HW, Yoo KY. Prevalence of otitis media and allied diseases in Korea-
results of a nation-wide survey, 1991. J Korean Med Sci 1993; 8: 34-40.
4. Kim JG, Sohn YT. Prevalence of otitis media with effusion in kindergarten children in
Taegu area. Korean J Otolaryngol-Head Neck Surg 1995; 38: 1695-703.
5. Yeom MS, Lee SY, Lee HJ, Jeong KY. Prevalence of silent otitis media with effusion in
preschool children in Kunsan city. J Korean Acad Fam Med 1997; 18: 46-52.
6. Pyo SY, Hong NP, Choo JH, Ahn HY, Cha CI, Jo JH. The prevalence of otitis media with
effusion among kindergarten and elementary school children in Song Buk, Seoul, Korea and risk
factors. Korean J Otolaryngol- Head Neck Surg 2000; 43: 1158-65.
7. Chae SW, Hwang KS, Suh HK, Lim HH, Jung HH, Hwang SJ. The point prevalence of
otitis media with effusion among kindergarten and elementary school children in Ansan area.
Korean J Otolaryngol-Head Neck Surg 1999; 42: 700-3.
8. Chang KH, Park SN, Kim HJ, Yoon HR. A prevalence study of otitis media with effusion
in kindergarten children in Puchun. Korean J Otolaryngol- Head Neck Surg 1997; 40: 374-81.
9. Facione N. Quality of life issues in chronic otitis media with effusion: parameters for
future study. Int J Pediatr Otorhinolaryngol 1991; 22: 167-79.
10. Kim SH, Hong HJ, Kim HJ. Effect of ventilation tube insertion on the quality of life.
Korean J Otolaryngol-Head Neck Surg 2003; 46: 296-301.
11. American Academy of Pediatrics Subcommittee on Management of Acute Otitis Media.
Diagnosis and management of acute otitis media. Pediatrics 2004; 113: 1451-65.
12. National Collaborating Centre for Women’s Health and Children’s Health. Surgical
management of otitis media with effusion in children. London: RCOG Press, 2008, p1-92.
13. Rosenfeld RM, Culpepper L, Doyle KJ, Grundfast KM, Hoberman A, Kenna MA,
Lieberthal AS, Mahoney M, Wahl RA, Woods CR Jr, et al. Clinical practice guideline: otitis media
with effusion. Otolaryngol Head Neck Surg 2004; 130: S95-118.
14. Subcommittee of Clinical Practice Guideline for Diagnosis and Management of Acute
Otitis Media in Children (Japan Otological Society, Japan Society for Pediatric
Otorhinolaryngology, Japan Society for Infectious Diseases in Otolaryngology). Clinical practice
guidelines for the diagnosis and management of acute otitis media (AOM) in children in Japan.
Auris Nasus Larynx 2012; 39: 1-8.
15. Marchisio P, Bellussi L, Di Mauro G, Doria M, Felisati G, Longhi R, Novelli A,
Speciale A, Mansi N, Principi N. Acute otitis media: from diagnosis to prevention. summary of the
Italian guideline. Int J Pediatr Otorhinolaryngol 2010; 74: 1209-16.
16. Choi EH. Emergence of macrolide resistance and clinical use of macrolide
antimicrobials in children. Korean J Pediatr 2008; 51: 1031-7.
17. Kang JH, Kim SM, Kim JH, Hur JK, Lee KY, Shin YK, Park SE, Ma SH, Hong YJ.
Penicillin resistant distribution and in-vitro susceptibility of oral antibiotics against Streptococcus
pneumoniae, isolated from pediatric patients with community- acquired respiratory infections in
Korea. Korean J Pediatr 2005; 48: 40-7.
18. Harabuchi Y, Kodama H, Faden H. Outcome of acute otitis media and its relation to
clinical features and nasopharyngeal colonization at the time of diagnosis. Acta Otolaryngol 2001;
121: 908-14.
19. Hotomi M, Yamanaka N, Shimada J, Ikeda Y, Faden H. Factors associated with clinical
outcomes in acute otitis media. Ann Otol Rhinol Laryngol 2004; 113: 846-52.
20. Hotomi M, Yamanaka N, Samukawa T, Suzumot M, Sakai A, Shimada J, Ikeda Y,
Faden H. Treatment and outcome of severe and non-severe acute otitis media. Eur J Pediatr 2005;
164: 3-8.
21. Jang CH, Kim YH. Clinical usefulness of temperature of tympanic membrane in
diagnosisg unilateral acute suppurative otitis media. Korean J Otolaryngol-Head Neck Surg 2000;
43: 715-8.
88
22. Revai K, Patel JA, Grady JJ, Chonmaitree T. Tympanometric findings in young children
during upper respiratory tract infections with and without acute otitis media. Pediatr Infect Dis J
2008; 27: 292-5.
23. Lee SW, Park SH, Chung YY, Oh CH. Tympanometric changes following acute otitis
media in children. Korean J Audiol 1999; 3: 123-30.
24. Rosenfeld RM, Kay D. Natural history of untreated otitis media. Laryngoscope 2003;
113: 1645-57.
25. Damoiseaux RA, van Balen FA, Hoes AW, Verheij TJ, de Melker RA. Primary care
based randomised, double blind trial of amoxicillin versus placebo for acute otitis media in children
aged under 2 years. BMJ 2000; 320: 350-4.
26. Siegel RM, Kiely M, Bien JP, Joseph EC, Davis JB, Mendel SG, Pestian JP, DeWitt TG.
Treatment of otitis media with observation and a safety-net antibiotic prescription. Pediatrics 2003;
112: 527-31.
27. Babin E, Lemarchand V, Moreau S, Goullet de Rugy M, Valdazo A, Bequignon A.
Failure of antibiotic therapy in acute otitis media. J Laryngol Otol 2003; 117: 173-6.
28. Glasziou PP, Del Mar CB, Sanders SL, Hayem M. Antibiotics for acute otitis media in
children. Cochrane Database Syst Rev 2004; CD000219.
29. Spiro DM, Tay KY, Arnold DH, Dziura JD, Baker MD, Shapiro ED. Waitand- see
prescription for the treatment of acute otitis media: a randomized controlled trial. JAMA 2006; 296:
1235-41.
30. Spiro DM, Arnold DH. The concept and practice of a wait-and-see approach to acute
otitis media. Curr Opin Pediatr 2008; 20: 72-8.
31. Brook I, Gober AE. Effect of amoxicillin and co-amoxiclav on the aerobic and anaerobic
nasopharyngeal flora. J Antimicrob Chemother 2002; 49: 689-92.
32. Park SE. Antibiotics therapy of respiratory infection in outpatients department. Korean J
Pediatr Infect Dis 2003; 10: 61-70.
33. Pichichero ME, Casey JR. Diagnostic inaccuracy and subject exclusions render placebo
and observational studies of acute otitis media inconclusive. Pediatr Infect Dis J 2008; 27: 958-62.
34. Kozyrskyj AL, Hildes-Ripstein GE, Longstaffe SE, Wincott JL, Sitar DS, Klassen TP,
Moffatt ME. Short course antibiotics for acute otitis media. Cochrane Database Syst Rev 2000;
CD001095.
35. Ovetchkine P, Cohen R. Shortened course of antibacterial therapy for acute otitis media.
Paediatr Drugs 2003; 5: 133-40.
36. Paik JY, Choi JH, Cho EY, Oh CE, Lee J, Choi EH, Lee HJ. Antibiotics susceptibility of
Streptococcus pneumoniae isolated from pharynx in healthy Korean children and choice of proper
empirical oral antibiotics using pharmacokinetics/pharmacodynamics model. Korean J Pediatr
Infect Dis 2011; 18: 109-16.
37. Ghaffar F, Muniz LS, Katz K, Reynolds J, Smith JL, Davis P, Friedland IR, McCracken
GH Jr. Effects of amoxicillin/clavulanate or azithromycin on nasopharyngeal carriage of
Streptococcus pneumoniae and Haemophilus influenzae in children with acute otitis media. Clin
Infect Dis 2000; 31: 875-80.
38. Ghaffar F, Muniz LS, Katz K, Smith JL, Shouse T, Davis P, McCracken GH Jr. Effects
of large dosages of amoxicillin/clavulanate or azithromycin on nasopharyngeal carriage of
Streptococcus pneumoniae, Haemophilus influenzae, nonpneumococcal α-hemolytic streptococci,
and Staphylococcus aureus in children with acute otitis media. Clin Infect Dis 2002; 34: 1301-9.
39. Coleman C, Moore M. Decongestants and antihistamines for acute otitis media in
children. Cochrane Database Syst Rev 2008; CD001727.
40. Asher E, Dagan R, Greenberg D, Givon-Lavi N, Libson S, Porat N, Leiberman A,
Leibovitz E. Persistence of pathogens despite clinical improvement in antibiotic-treated acute otitis
media is associated with clinical and bacteriologic relapse. Pediatr Infect Dis J 2008; 27: 296-301.
89
41. Dagan R, Barkai G, Givon-Lavi N, Sharf AZ, Vardy D, Cohen T, Lipsitch M, Greenberg
D. Seasonality of antibiotic-resistant Streptococcus pneumonia that causes acute otitis media: a clue
for an antibiotic-restriction policy? J Infect Dis 2008; 197: 1094-102.
42. Lubianca Neto JF, Hemb L, Silva DBE. Systematic literature review of modifiable risk
factors for recurrent acute otitis media in childhood. J Pediatr (Rio J) 2006; 82: 87-96.
43. Pavia M, Bianco A, Nobile CGA, Marinelli P, Angelillo IF. Efficacy of pneumococcal
vaccination in children younger than 24 months: a meta-analysis. Pediatrics 2009; 123: e1103-10.
44. Jang GC, Shin KM, Yong DE, Lee KW, Kim DS. Changing patterns of antibiotic-
resistant rates and clinical features in pneumococcal infections. Korean J Pediatr Infect Dis 2003;
10: 81-6.
45. Kim SM, Hur JK, Lee KY, Shin YK, Park SE, Ma SH, Min AY, Kang JH.
Epidemiological study of pneumococcal nasal carriage and serotypes among Korean children.
Korean J Pediatr 2004; 47: 611-6.
46. Straetemans M, Sanders EA, Veenhoven RH, Schilder AG, Damoiseaux RA, Zielhuis
GA. Review of randomized controlled trials on pneumococcal vaccination for prevention of otitis
media. Pediatr Infect Dis J 2003; 22: 515-24.
47. Thorne MC, Chewaproug L, Elden LM. Suppurative complications of acute otitis media:
changes in frequency over time. Arch Otolaryngol Head Neck Surg 2009; 135: 638-41.
48. Karkos PD, Leong SC, Arya AK, Papouliakos SM, Apostolidou MT, Issing WJ.
«Complementary ENT»: a systematic review of commonly used supplements. J Laryngol Otol
2007; 121: 779-82.
49. Lee DH. How to improve the accuracy of diagnosing otitis media with effusion in a
pediatric population. Int J Pediatr Otorhinolaryngol 2010; 74: 151-3.
50. Young DE, Ten Cate WJ, Ahmad Z, Morton RP. The accuracy of otomicroscopy for the
diagnosis of paediatric middle ear effusions. Int J Pediatr Otorhinolaryngol 2009; 73: 825-8.
51. Diefendorf A. Detection and assessment of hearling loss in infants and children. In: Katz
J, editor. Handbook of clinical audiology. 5th ed. Philadelphia, PA: Lippincott Williams & Wilkins,
2002, p469-80.
52. Valtonen H, Dietz A, Qvarnberg Y. Long-term clinical, audiologic, and radiologic
outcomes in palate cleft children treated with early tympanostomy for otitis media with effusion: a
controlled prospective study. Laryngoscope 2005; 115: 1512-6.
53. Lee HK, Koh KM, Kim KR, Park CW, Ahn KS, Uhm KI. Evaluation of otitis media
with effusion in cleft palate patients. Korean J Otolaryngol- Head Neck Surg 1995; 38: 230-5.
54. Flynn T, Mцller C, Jцnsson R, Lohmander A. The high prevalence of otitis media with
effusion in children with cleft lip and palate as compared to children without clefts. Int J Pediatr
Otorhinolaryngol 2009; 73: 1441-6.
55. Griffin G, Flynn CA. Antihistamines and/or decongestants for otitis media with effusion
(OME) in children. Cochrane Database Syst Rev 2011; CD003423.
56. Williamson I, Benge S, Barton S, Petrou S, Letley L, Fasey N, Abangma G, Dakin H,
Little P. A double-blind randomised placebo-controlled trial of topical intranasal corticosteroids in
4- to 11-year-old children with persistent bilateral otitis media with effusion in primary care. Health
Technol Assess 2009; 13: 1-144.
57. Petrou S, Dakin H, Abangma G, Benge S, Williamson I. Cost-utility analysis of topical
intranasal steroids for otitis media with effusion based on evidence from the GNOME trial. Value in
Health 2010; 13: 543-51.
58. Mandel EM, Casselbrant ML, Rockette HE, Fireman P, Kurs-Lasky M, Bluestone CD.
Systemic steroid for chronic otitis media with effusion in children. Pediatrics 2002; 110: 1071-80.
59. Simpson SA, Lewis R, van der Voort J, Butler CC. Oral or topical nasal steroids for
hearing loss associated with otitis media with effusion in children. Cochrane Database Syst Rev
2011; CD001935.
90
60. Choung YH, Shin YR, Choi SJ, Park K, Park HY, Lee JB, Han DH, Kahng H.
Management for the children with otitis media with effusion in the tertiary hospital. Clin Exp
Otorhinolaryngol 2008; 1: 201-5.
61. Perera R, Haynes J, Glasziou P, Heneghan CJ. Autoinflation for hearing loss associated
with otitis media with effusion. Cochrane Database Syst Rev 2006; CD006285.
62. Maw R, Wilks J, Harvey I, Peters TJ, Golding J. Early surgery compared with watchful
waiting for glue ear and effect on language development in preschool children: a randomised trial.
Lancet 1999; 353: 960-3.
63. Rach GH, Zielhuis GA, van Baarle PW, van den Broek P. The effect of treatment with
ventilating tubes on language development in preschool children with otitis media with effusion.
Clin Otolaryngol Allied Sci 1991; 16: 128-32.
64. Stenstrom R, Pless IB, Bernard P. Hearing thresholds and tympanic membrane sequelae
in children managed medically or surgically for otitis media with effusion. Arch Pediatr Adolesc
Med 2005; 159: 1151-6.
65. Lous J. Which children would benefit most from tympanostomy tubes (grommets)? A
personal evidence-based review. Int J Pediatr Otorhinolaryngol 2008; 72: 731-6.
66. Rovers MM, Straatman H, Ingels K, van der Wilt GJ, van den Broek P, Zielhuis GA.
The effect of ventilation tubes on language development in infants with otitis media with effusion: a
randomized trial. Pediatrics 2000; 106: e42.
67. Paradise JL, Feldman HM, Campbell TF, Dollaghan CA, Colborn DK, Bernard BS,
Rockette HE, Janosky JE, Pitcairn DL, Sabo DL, et al. Effect of early or delayed insertion of
tympanostomy tubes for persistent otitis media on developmental outcomes at the age of three
years. N Engl J Med 2001; 344: 1179-87.
68. Paradise JL, Dollaghan CA, Campbell TF, Feldman HM, Bernard BS, Colborn DK,
Rockette HE, Janosky JE, Pitcairn DL, Kurs-Lasky M, et al. Otitis media and tympanostomy tube
insertion during the first three years of life: developmental outcomes at the age of four years.
Pediatrics 2003; 112: 265-77.
69. Paradise JL, Campbell TF, Dollaghan CA, Feldman HM, Bernard BS, Colborn DK,
Rockette HE, Janosky JE, Pitcairn DL, Kurs-Lasky M. Developmental outcomes after early or
delayed insertion of tympanostomy tubes. N Engl J Med 2005; 353: 576-86.
70. Paradise JL, Feldman HM, Campbell TF, Dollaghan CA, Rockette HE, Pitcairn DL,
Smith CG, Colborn DK, Bernard BS, Kurs-Lasky M, et al. Tympanostomy tubes and
developmental outcomes at 9 to 11 years of age. N Engl J Med 2007; 356: 248-61.
71. Browning GG, Rovers MM, Williamson I, Lous J, Burton MJ. Grommets (ventilation
tubes) for hearing loss associated with otitis media with effusion in children. Cochrane Database
Syst Rev 2010; CD001801.
72. Valtonen HJ, Qvarnberg YH, Nuutinen J. Otological and audiological outcomes five
years after tympanostomy in early childhood. Laryngoscope 2002; 112: 669-75.
73. Valtonen H, Tuomilehto H, Qvarnberg Y, Nuutinen J. A 14-year prospective follow-up
study of children treated early in life with tympanostomy tubes: part 1: clinical outcomes. Arch
Otolaryngol Head Neck Surg 2005; 131: 293-8.
74. Valtonen H, Tuomilehto H, Qvarnberg Y, Nuutinen J. A 14-year prospective follow-up
study of children treated early in life with tympanostomy tubes: part 2: hearing outcomes. Arch
Otolaryngol Head Neck Surg 2005; 131: 299-303.
75. Cayé-Thomasen P, Stangerup SE, Jшrgensen G, Drozdziewic D, Bonding P, Tos M.
Myringotomy versus ventilation tubes in secretory otitis media: eardrum pathology, hearing, and
eustachian tube function 25 years after treatment. Otol Neurotol 2008; 29: 649-57.
76. Park CW, Park IB, Choi JS, Jeong YG, Ahn KS. Factors that affect the development of
tympanosclerosis after ventilation tube insertion. Korean J Otolaryngol-Head Neck Surg 2000; 43:
15-9.
77. van den Aardweg MT, Schilder AG, Herkert E, Boonacker CW, Rovers MM.
Adenoidectomy for otitis media in children. Cochrane Database Syst Rev 2010; CD007810.
91
78. Jung MK, Yeo SW, Lee IR, Park JW, Nam JS. Efficacy of adenoidectomy in preventing
recurrence of otitis media with effusion. Korean J Otolaryngol- Head Neck Surg 2004; 47: 293-8.
79. Paradise JL, Bluestone CD, Colborn DK, Bernard BS, Smith CG, Rockette HE, Kurs-
Lasky M. Adenoidectomy and adenotonsillectomy for recurrent acute otitis media: parallel
randomized clinical trials in children not previously treated with tympanostomy tubes. JAMA 1999;
282: 945-53.
80. Kadhim AL, Spilsbury K, Semmens JB, Coates HL, Lannigan FJ. Adenoidectomy for
middle ear effusion: a study of 50,000 children over 24 years. Laryngoscope 2007; 117: 427-33.
«MANAGEMENT OF ACUTE OTITIS MEDIA IN CHILDREN SIX MONTHS OF AGE AND
OLDER», Canadian Paediatric Society Infectious Diseases and Immunization Committee
Paediatr Child Health 2016.
1. Forgie S, Zhanel G, Robinson J; CPS Infectious Diseases and Immunization Committee.
Management of acute otitis media – a summary. Paediatr Child Health 2009;14(7):457-64.
2. Vergison A, Dagan R, Arguedas A, et al. Otitis media and its consequences: Beyond the
earache. Lancet Infect Dis 2010;10(3):195-203.
3. Coticchia JM, Chen M, Sachdeva L, Mutchnick S. New paradigms in the pathogenesis of
otitis media in children. Front Pediatr 2013;1:52.
4. Marom T, Nokso-Koivisto J, Chonmaitree T. Viral-bacterial interactions in acute otitis
media. Curr Allergy Asthma Rep 2012;12(6):551-8.
5. Macintyre EA, Karr CJ, Koehoorn M, et al. Otitis media incidence and risk factors in a
population-based birth cohort. Paediatr Child Health 2010;15(7):437-42.
6. Moore HC, Jacoby P, Taylor A, et al. The interaction between respiratory viruses and
pathogenic bacteria in the upper respiratory tract of asymptomatic Aboriginal and non-Aboriginal
children. Pediatr Infect Dis J 2010;29(6):540-5.
7. Marchisio P, Nazzari E, Torretta S, Esposito S, Principi N. Medical prevention of
recurrent acute otitis media: An updated overview. Expert Rev Anti Infect Ther 2014;12(5):611-20.
8. Bakaletz LO. Bacterial biofilms in the upper airway – Evidence for role in pathology and
implications for treatment of otitis media. Paediatr Respir Rev 2012;13(3):154-9.
9. Verhoeven D, Pichichero ME. Divergent mucosal and systemic responses in children in
response to acute otitis media. Clin Exp Immunol 2014;178(1):94-101.
10. Palmu AA, Herva E, Savolainen H, Karma P, Mäkelä PH, Kilpi TM. Association of
clinical signs and symptoms with bacterial findings in acute otitis media. Clin Infect Dis
2004;38(2): 234-42.
11. Kalu SU, Ataya RS, McCormick DP, Patel JA, Revai K, Chonmaitree T. Clinical
spectrum of acute otitis media complicating upper respiratory tract viral infection. Pediatr Infect Dis
J 2011;30(2):95-9.
12. Pettigrew MM, Gent JF, Pyles RB, Miller AL, Nokso-Koivisto J, Chonmaitree T. Viral-
bacterial interactions and risk of acute otitis media complicating upper respiratory tract infection. J
Clin Microbiol 2011;49(11):3750-5.
13. Casey JR, Adlowitz DG, Pichichero ME. New patterns in the otopathogens causing
acute otitis media six to eight years after introduction of pneumococcal conjugate vaccine. Pediatr
Infect Dis J 2010;29(4):304-9.
14. Cohen R, Levy C, Bingen E, Koskas M, Nave I, Varon E. Impact of 13-valent
pneumococcal conjugate vaccine on pneumococcal nasopharyngeal carriage in children with acute
otitis media. Pediatr Infect Dis J 2012;31(3):297-301.
15. Taylor S, Marchisio P, Vergison A, Harriague J, Hausdorff WP, Haggard M. Impact of
pneumococcal conjugate vaccination on otitis media: A systematic review. Clin Infect Dis
2012;54(12): 1765-73.
16. De Wals PD, Carbon M, Sévin E, Deceuninck G, Ouakki M. Reduced physician claims
for otitis media after implementation of pneumococcal conjugate vaccine program in the province
of Quebec, Canada. Pediatr Infect Dis J 2009;28(9):e271-5.
92
17. Tamir S, Roth Y, Dalal I, Goldfarb A, Grotto I, Marom T. Changing trends of acute
otitis media bacteriology in Israel in the pneumococcal conjugate vaccine era. Pediatr Infect Dis J
2014;34:1959.
18. Ben-Shimol S, Givon-Lavi N, Leibovitz E, Raiz S, Greenberg D, Dagan R. Near-
elimination of otitis media caused by 13-valent pneumococcal conjugate vaccine (PCV) serotypes
in southern Israel shortly after sequential introduction of 7-valent/13-valent PCV. Clin Infect Dis
2014;59(12):1724-32.
19. Le Saux N, Gaboury I, Baird M, et al. A randomized, doubleblind, placebo-controlled
noninferiority trial of amoxicillin for clinically diagnosed acute otitis media in children 6 months to
5 years of age. CMAJ 2005;172(3):335-41.
20. Dagan R, Schneider S, Givon-Lavi N, et al. Failure to achieve early bacterial eradication
increases clinical failure rate in acute otitis media in young children. Pediatr Infect Dis J
2008;27(3): 200-6.
21. Hoberman A, Paradise JL, Rockette HE, et al. Treatment of acute otitis media in
children under 2 years of age. N Engl J Med 2011;364(2):105-15.
22. Tähtinen PA, Laine MK, Huovinen P, Jalava J, Ruuskanen O, Ruohola A. A placebo-
controlled trial of antimicrobial treatment for acute otitis media. N Engl J Med 2011;364(2):116-26.
23. Shaikh N, Hoberman A, Paradise JL, et al. Development and preliminary evaluation of a
parent-reported outcome instrument for clinical trials in acute otitis media. Pediatr Infect Dis J
2009;28(1):5-8.
24. Laine MK, Tähtinen PA, Ruuskanen O, Huovinen P, Ruohola A. Symptoms or
symptom-based scores cannot predict acute otitis media at otitis-prone age. Pediatrics
2010;125(5):e1154-61.
25. Onusko E. Tympanometry. Am Fam Physician 2004;70(9): 1713-20.
26. Takata GS, Chan LS, Morphew T, Mangione-Smith R, Morton SC, Shekelle P. Evidence
assessment of the accuracy of methods of diagnosing middle ear effusion in children with otitis
media with effusion. Pediatrics 2003;112(6 Pt 1):1379-87.
27. Chonmaitree T, Alvarez-Fernandez P, Jennings K, et al. Symptomatic and asymptomatic
respiratory viral infections in the first year of life: Association with acute otitis media development.
Clin Infect Dis 2015;60(1):1-9.
28. McCormick DP, Chonmaitree T, Pittman C, et al. Nonsevere acute otitis media: A
clinical trial comparing outcomes of watchful waiting versus immediate antibiotic treatment.
Pediatrics 2005;115(6):1455-65.
29. Karma PH, Penttilä MA, Sipilä MM, Kataja MJ. Otoscopic diagnosis of middle ear
effusion in acute and non-acute otitis media. I. The value of different otoscopic findings. Int J
Pediatr Otorhinolaryngol 1989;17(1):37-49.
30. McCormick DP, Lim-Melia E, Saeed K, Baldwin CD, Chonmaitree T. Otitis media: Can
clinical findings predict bacterial or viral etiology? Pediatr Infect Dis J 2000;19(3):256-8.
31. Friedman NR, McCormick DP, Pittman C, et al. Development of a practical tool for
assessing the severity of acute otitis media. Pediatr Infect Dis J 2006;25(2):101-7.
32. Shaikh N, Hoberman A, Rockette HE, Kurs-Lasky M. Development of an algorithm for
the diagnosis of otitis media. Acad Pediatr 12(3):214-8.
33. Leibovitz E, Serebro M, Givon-Lavi N, et al. Epidemiologic and microbiologic
characteristics of culture-positive spontaneous otorrhea in children with acute otitis media. Pediatr
Infect Dis J 2009;28(5):381-4.
34. Shaikh N, Hoberman A, Kaleida PH, Ploof DL, Paradise JL. Videos in clinical
medicine. Diagnosing otitis media – Otoscopy and cerumen removal. N Engl J Med
2010:362(20):e62.
35. Mattos JL, Colman KL, Casselbrant ML, Chi DH. Intratemporal and intracranial
complications of acute otitis media in a pediatric population. Int J Pediatr Otorhinolaryngol
2014;78(12): 2161-4.
93
36. Hoberman A, Ruohola A, Shaikh N, Tähtinen PA, Paradise JL. Acute otitis media in
children younger than 2 years. JAMA Pediatr 2013;167(12):1171-2.
37. Powis J, McGeer A, Green K, et al. In vitro antimicrobial susceptibilities of
Streptococcus pneumoniae clinical isolates obtained in Canada in 2002. Antimicrob Agents
Chemother 2004;48(9):3305-11.
38. Leal J, Vanderkooi OG, Church DL, MacDonald J, Tyrrell GJ, Kellner JD. Eradication
of invasive pneumococcal disease due to the seven-valent pneumococcal conjugate vaccine
serotypes in Calgary, Alberta. Pediatr Infect Dis J 2012;31(9):e169-75.
39. Vanderkooi OG, McConnell A, Church DL, Kellner JD. Antimicrobial susceptibility of
invasive and lower respiratory tract isolates of Streptococcus pneumoniae, 1998 to 2007. Can J
Infect Dis Med Microbiol 2009;20(4):e139-44.
40. Piglansky L, Leibovitz E, Raiz S, et al. Bacteriologic and clinical efficacy of high dose
amoxicillin for therapy of acute otitis media in children. Pediatr Infect Dis J 2003;22(5):405-13.
41. Block SL, Hedrick J, Tyler R, et al. Increasing bacterial resistance in pediatric acute
conjunctivitis (1997-1998). Antimicrob Agents Chemother 2000;44(6):1650-4.
42. Lagacé-Wiens P, Rubinstein E. Adverse reactions to ß-lactam antimicrobials. Expert
Opin Drug Saf 2012;11(3):381-99.
43. Cohen R, Ovetchkine P, Géhanno P. Current approaches to otitis media. Curr Opin
Infect Dis 2001;14(3):337-42.
44. Pichichero ME, Marsocci SM, Murphy ML, Hoeger W, Francis AB, Green JL. A
prospective observational study of 5-, 7-, and 10-day antibiotic treatment for acute otitis media.
Otolaryngol Head Neck Surg 2001;124(4):381-7.
45. Kozyrskyj A, Klassen TP, Moffatt M, Harvey K. Short-course antibiotics for acute otitis
media. Cochrane Database Syst Rev 2010;9:CD001095.




